高三化学第一学期期末试题
化 学
注意:(1)本卷分I、II两卷,满分100分,考试时间为100分钟。
(2)请把所有答案写在答卷中,做在试卷中无效。
(3)可能用到的相对原子质量:
H-1 C-12 O-16 Na-23 S-16 C1-35.5 Ca-40 Cu-64 Br-80 Ba-137
第I卷(共42分)
一、选择题(本题包括12小题,每小题2分,共24分。每小题只有一个选项符合题意)
l、金属钛(Ti)常被称为未来钢铁,钛元素的同位素4622Ti、4822Ti、4922Ti、5022Ti中,中子数不可能为
A.24 B.26 C.28 D.30
2、下列关于生活中的化学知识叙述正确的是
A.某种口服液含丰富的氮、磷、锌等微量元素
B.用纯碱溶液除去水壶中的水垢
C.硫酸铜可用于游泳池池水的消毒,也可用于自来水消毒
D.加碘食盐开袋后,不宜长期放置后食用
3、在下列反应中,水既不是氧化剂又不是还原剂的是
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
c.C12+H2O=HC1+HC1O D.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
4、下列说法或表示法正确的是
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol,若将含0.5mol H2SO4
的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.1molS完全燃烧放热297.3kJ,其热化学方程式为:S+O2=SO2,△H=-297.3kJ/mol
5、下列说法中正确的是(NA代表阿伏加德罗常数)
A.9g水所含的质子数为9NA
B.常温常压下,活泼金属从盐酸中置换出1mol H2,转移的电子数目为2NA
C.1mol/L的Na2CO3溶液100mL中含CO32一离子数为0.1NA
D.常温常压下,22.4L CO2所含原子数为3NA
6、下列叙述中,正确的是
A.原子晶体中只含有非极性键
B.金属在常温时都以金属晶体形式存在
C.离子晶体一定是由金属与非金属元素组成
D.分子晶体中一定有分子间作用力,有的还可能有氢键
7、下列反应中,能说明卤素单质的氧化性强弱顺序为Cl2>Br2>I2的是
①2HClO4+Br2=2HBrO4+C12↑ ②2NaBr+C12=2NaC1+Br2
③2KI+C12=2KC1+I2 ④2KI+Br2=KBr+I2
A.①②③ B.①②④ C.②③④ D.①②③④
8、将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如下图
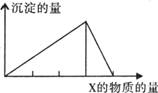 所示,符合图示情况的是
所示,符合图示情况的是
| A | B | C | D | |
| X | CO2 | HC1 | NaOH | A1Cl3 |
| Y | Ca(OH)2 | NaAlO2 | A1Cl3 | NaOH |
9、为除去括号内的杂质,所选用的试剂或方法不正确的是
A.NO(NO2)-通入足量水中,再用向上排空气法收集气体
B.NaHCO3溶液(Na2CO3)-通入过量CO2
C.Cl2(HC1)-用排饱和NaC1溶液收集气体
D.CuO(C)-直接在空气中加热
10、下列反应的离子方程式书写正确的是
A.碳酸氢钠溶液与盐酸反应:HCO3-+H+=CO2↑+H2O
B.氯化铝溶液加入过量氨水:A13++4OH-=A1O2-+2H2O
C.碳酸钾晶体溶于水:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
D.H2SO4与Ba(OH)2反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
11、某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。经检验,甲厂的废水明显呈碱性,则甲、乙两厂废水中所含的三种离子分别是
| 甲厂 | 乙厂 | |
| A | Ag+、Fe3+、NO3- | K+、OH-、Cl- |
| B | K+、OH-、Cl- | Ag+、Fe3+、NO3- |
| C | Ag+、Fe3+、C1- | K+、OH-、NO3- |
| D | Fe3+、OH-、Cl- | K+、Ag+、OH- |
12、下列有关化工生产的叙述正确的是
A.工业生产硝酸时用O2氧化N2得NO
B.氯碱工业常使用阳离子交换膜可提高产品烧碱溶液的质量
C.合成氨工业中使用催化剂有利于平衡向合成氨的方向移动
D.硫酸二[业中常用水吸收SO3以获得H2SO4
二、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
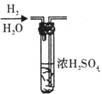
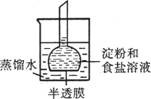 13、如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液厩略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液去检验。实验过程中,观察到的现象是
13、如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液厩略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液去检验。实验过程中,观察到的现象是
A.长颈漏斗内液体加碘水无明显变化
B.漏斗颈内液面不变
C.烧杯内液体遇硝酸银溶液有白色沉淀生成
D.烧杯内液体遇碘水变蓝
14、在蒸馏水中加入足量的相等物质的量的Ca2+、Na+、Ba2+、Cl-、CO32-、SO42-,再用惰性电极电解该溶液,则在阳极与阴极得到的气体的质量之比为
A.2:71 B.71:2 C.1:8 D.8:1
15、下列关于实验的叙述中,正确的是
①中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并在锥形瓶内滴入几滴
指示剂
②配制NaOH溶液时,将称好的NaOH同体溶于适量水,立即转移到容量瓶中
③制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再注入
NaOH溶液
④把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡产生速率加快
A.①② B.①③ C.②④ D.③④
16、常温时有以下三种溶液:a.Ba(OH)2,b.NaOH,c.NH3·H2O。下列说法正确的是
A.同物质的量浓度的三种溶液的pH:a>b>c
B.同pH的三种溶液稀释相同倍数后,pH:a>b>c
C.中和同pH、同体积的三种溶液消耗同物质的量浓度的盐酸的体积:a=b=c
D.同pH的三种溶液稀释不同倍数,pH仍相同,则三种溶液稀释的倍数:a>b>c
17、己知NaHSO3溶液呈酸性,现有浓度为0.1 m01·L-1的NaHSO3溶液,有关离子浓度的关系正确的是
A.c(Na+)>c(H+)>c(HSO3一)>c(SO32-)>c(OH-)
B.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-)
C.c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
D.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
l 8、将25.6gCu与含0.3mol H2SO4的浓硫酸充分反应后,消耗了0.2mol的H2SO4(气体全部逸出),在剩余物质中加入100mL 2 m01·L-1的稀硝酸,充分反应后产生NO的量为
A.0.05 mol B.0.1 mol C.0.15 mol D.0.2 mol
 第II卷(共58分)
第II卷(共58分)
三、填空题(共32分)
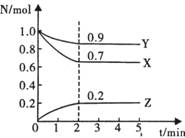
19、(6分)常温时,在一个2L的固定体积的密闭容器
中,X、Y、Z三种气态物质的物质的量随时间的变
化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)从开始至2min,以X的浓度变化表示的平均
反应速率为 ;
(3)平衡时升高温度,发现Z的浓度增大,则正反应为 (填“放热”或“吸热")反应。
20、 (9分)有A、B、C、D、E、F六种短周期元素,其原子序数依次递增。lmolE元素
的单质与盐酸完全反应时,有1.204×1024个电子发生转移。C、F两元素间可形成FC2
和FC3两种化合物。A、D均能与C按原子个数比1:1和2:1形成两种化合物,其
中含A的两种化合物通常状况下为液态,含D的两种化合物通常情况下为固态。又
知A、B、D三种元素原子序数之和是C、E、F三种元素原子序数之和的1/2。
请回答下列问题:
(1)写出下列化学用语:
B的原子结构示意图 ,D与C按原子个数比2:1形成化合物的电子式 ;
(2)E位于周期表的第 周期,第 族;
(3)B在C中完全燃烧生成的化合物微粒的空间构型是 ,此物质在固态时
属于 晶体;
(4)沸点A2C A2F(填“大于”、“小于") ;其原因是 。
21、(9分)单质甲、乙、丙有如下转化关系(反应物和生成物中的水及反应条件已略去)。
常温常压时,丙、X、Y、Z都是气体,X与Y、Z与W相对分子质量分别相差16,
其中A为弱酸,B为强酸。
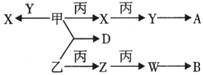
(1)丙的一种同素异形体与人类的生存环境关系密切,该同素异形体的分子式为: 。
(2)写出Mg在Y中燃烧的反应方程式: 。
(3)已知Y、D的分子结构相似,则D的结构式为 。
(4)请写出鉴别Y和Z的一种试剂: 。
22、(8分)科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃
料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工
作原理的示意图如下:
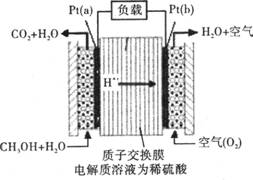
甲醇燃料电池工作原理示意图
请回答下列问题:
(1)Pt(a)电极是电池的 极,电极反应式为 ;
Pt(b)电极发生 反应(填“氧化"或“还原"),电极反应式为 ;
(2)电池的总反应方程式为 。
(3)如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有 mol。
四、实验题(共20分)
23、 (8分)判断下列各图中所示的实验方法、装置或操作有无错误,若有错误,指出错
|
(1)氢气的干燥 |
(2)取固体药品 |
(3)过滤 |
(4)读取液体体积 | |
| 判断对错 | ||||
| 错误或改进 |
24、 (12分)课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
![]()
如图是关于‘‘一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。
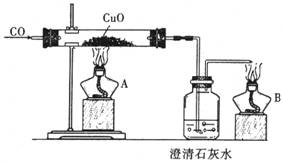
(1)实验时应先点燃 处(填“A"或“B”)的酒精灯。
(2)硬质试管中反应的化学方程式为 。
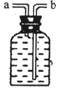
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图是他
设计的贮气瓶,尾气应从 (选a、b填空)口通入(其它装置略)。
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,
应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为
丙的设计是否有必要 ,理由是 。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?
。
五、计算题(6分)
25、(6分)电子工业上常用氯化铁溶液腐蚀铜来制印刷电路板,现将一定量铜粉放入氯化
铁溶液中,完全反应后,溶液中Cu2+和Fe3+浓度相等。
(1)写出铜粉与氯化铁反应离子方程式: :
(2)溶液中Fe2+和Fe3+的物质的量浓度之比为: :
(3)若再向上述所得溶液中加入一定量铁粉,经充分反应后,溶液中金属阳离子只有
Fe2+,此时参加反应的铁粉与原FeCl3的物质的量之比为: 。
化学参考答案
第I卷(共42分)
一、选择题(本题包括12小题,每小题2分,共24分。每小题只有一个选项符合题意)
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | l 1 | 12 |
| 答案 | D | D | C | C | B | D | C | C | A | A | B | B |
二、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
| 题号 | 13 | 14 | 15 | 16 | 1 7 | 18 |
| 答案 | C | B | D | A | C | B |
第II卷(共58分)
三、填空题(共32分)
19、(6分)
(1)3X+Y![]() 2Z(2分)(无可逆符号给1分)
2Z(2分)(无可逆符号给1分)
(2)0.075 mol·L-1·min-1(2分)(无单位不给分)
(3)吸热(2分)
20、(9分)
(1)![]() (1分)
(1分)![]() (1分)
(1分)
(2)3(1分),II A(1分) (写第二主族类不给分)
(3)直线型(1分) 分子晶体(1分)
(4)大于(1分) (填>亦可)水分子间存在氢键,使分子间作用力明显比硫化氢大,沸点高。 (2分)(回答到氢键即可)
21、(9分)
(1)O3(2分)(写名称给1分)
(2)2Mg+CO2![]() 2MgO+C(3分)(点燃加热均可,但无条件给1分)
2MgO+C(3分)(点燃加热均可,但无条件给1分)
(3)S=C=S(2分)
(4)溴水或品红溶液或酸性高锰酸钾溶液(2分)
22、(8分)
(1)负极,CH3OH+H2O-6e-=CO2+6H+;还原,O2+4H++4e-=2H2O。(各1分)
(2)2CH3OH+3O2=2CO2+4H2O(2分)
(3)1/3(2分)
四、实验题(共20分)
23、(8分)
(1)错(1分)(×),导管进出位置错(导管应长进短出)(1分)
(2)错(1分)(×),瓶盖放错了(瓶盖应倒放)(1分)
(3)错(1分)(×),没用玻璃棒引流(应用玻璃棒引流)(1分)
(4)对(2分)(√)
24、(12分)
(1)B(2分)
(2)CuO+CO![]() Cu+CO2(2分)(无条件给1分)
Cu+CO2(2分)(无条件给1分)
(3)a(2分)
(4)不必要(2分) 在酒精灯A点燃前,CO已通过了澄清石灰水(2分)
(5)先通过碱石灰除去CO2后再通入装置(2分)(通过NaOH溶液亦可)
五、计算题(6分)
25、(6分)
(1)2Fe3++Cu=2Fe2++Cu2+(2分)(写化学方程式不得分)
(2)2:l(2分)
(3)l:2(2分)