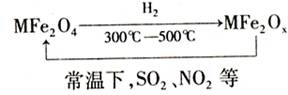高三化学第一学期期末质量检测试题
化 学 试 题
考生注意:本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)。考试时间100分钟,满分100分。
可能用到的相对原子质量:H:1; C:12; O:16 S:32; Cu:64
第Ⅰ卷(选择题,共50分)
本卷包括16小题,每题只有一个选项符合题意。1—8小题每题2分;9—16小题每题3分
1.生活中碰到的某些问题常涉及到化学知识,下列叙述中错误的是 ( )
A.凡含有食品添加剂的食物对人体健康均有害,不宜食用
B.废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源
C.大气污染物SO2、CO和NO2主要来源于煤的燃烧和汽车排放的尾气
D.变质的油脂有难闻的特殊气味,是由于油脂发生了化学变化
2.意大利科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示。下列说法正确的是 ( )
A.N4属于一种新型的化合物
B.N4和P4(白磷)的晶体都属于分子晶体
C.N4与N2互为同分异构体
D.N4与N2互为同系物
3.具有相同电子层结构的三种粒子An+1、Bn-和C,下列判断正确的是 ( )
A.原子序数C>B>A B.微粒半径An+1>Bn-
C.原子半径A<B D.C是稀有气体元素的原子
4.下列化学用语表示正确的是 ( )
A.氯化钠的电子式为![]()
B.次氯酸的电子式![]()
C.二氧化碳的结构式为O=C=O
D.NaHCO3的电离方程式为NaHCO3=Na++H++CO32-
5.下列实验不能达到预期目的的是 ( )
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | MgCl2、AlCl3浓液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的Na3PO4、Na2SO4两溶液的PH | 比较磷、硫的非金属性强弱 |
| D | 用等浓度的盐酸、碳酸氢钠两溶液混合反应 | 比较盐酸、碳酸的酸性强弱 |
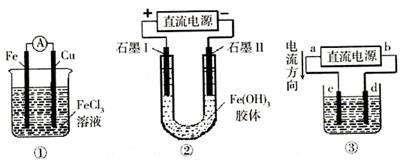
6.关于下图所示各装置的叙述中,正确的是 ( )
|
A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3++e-=Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
7.下列离子方程式正确的是 ( )
A.NaHCO3溶液和NaOH溶液混合HCO3-+OH CO2↑+H2O
B.将少量的二氧化硫气体通入氯化钙溶液中SO2+H2O+Ca2+ CaSO3↓+2H+
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
D.铜片与稀HNO3反应:3Cu+2NO3-+8H+
3Cu2++2NO↑+4H2O
|
有关上述转化过程的下列叙述正确的是 ( )
A.MFe2O4表现了还原性 B.MFe2OX表现了还原性
C.SO2和NO2表现了还原性 D.SO2和NO2发生了分解反应
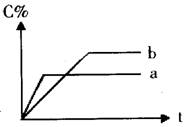
![]() 9.右图表示可逆反应A(固)+B(气) nC(气);
9.右图表示可逆反应A(固)+B(气) nC(气);
△H=Q(n为正整数)在不同条件下反应混合物中
|
下列有关叙述中一定正确的是( )
A.其他条件相同,a表示使用了催化剂,b没有使
用催化剂
B.其他条件相同,若只改变温度,则a比b的温
度高且△H>0
C.其他条件相同,若只改变压强,则a比b的压
强大且n≥2
D.其他条件相同,若改变A的物质的量,则a比
b用A的物质的量少
10.下列叙述正确的是 ( )
A.NaHCO3与石灰水反应,当n(NaHCO3):n(Ca(OH)2)=1:1时,溶液中无CO32-
B.CO2通入石灰水中,当n(CO2):n(Ca(OH)2)=1:1时,能得到澄清溶液
C.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时,Al元素以Al2-形式存在
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在
11.向一定质量的饱和CuSO4溶液中加入ag无水CuSO4粉末得bg晶体。下列有关叙述正确的是 ( )
A.溶液质量增加ag B.溶液质量减少bg
C.溶液质量减少(b-a)g D.溶液质量减少![]() ag
ag
12.常温下,1体积pH=11.5的强碱溶液与10体积某浓度的盐酸恰好完全反应,则该盐酸的pH等于 ( )
A.1.5 B.2.5 C.3 D.3.5
13.下列叙述正确的是 ( )
A.18gD2O中含有的质子数为10×6.02×1023个
B.1mol碳正离子(CH5+)中含电子数为10×6.02×1023个
C.44gC3H8分子中含共价键数为11×6.02×1023个
D.1Lmol·L-1醋酸溶液中离子总数为2×6.02×1023个
13.下列叙述正确的是 ( )
A.18gD2O中含有的质子数为10×6.02×1023个
B.1mol碳正离子(CH5+)中含电子数为10×6.02×1023个
C.44gC3H8分子中含共价键数为11×6.02×1023个
D.1Lmol·L-1醋酸溶液中离子总数为2×6.02×1023个
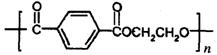
14.某些毛绒玩具的内充物为无毒的聚酯纤维,其结构简式为:
|
下列说法正确的是 ( )
A.羊毛与聚酯纤维的化学成分相同
B.聚酯纤维在强碱溶液中能水解
C.合成聚酯纤维的反应属于加聚反应
D.聚酯纤维可以认为是苯甲酸和乙醇经酯化反应生成
15.将稀硝酸与稀氨水混合,不可能出现的结果是 ( )
A.pH=7,且c(NH4+)=c(NO3-)>c(H+)=c(OH-)
B.pH<7,且c(NH3+)+c(OH-)=c(H+)+c(OH4+)
C.pH<7,且c(H+)>c(OH3-)>c(OH-)>c(OH4+)
D.pH>7,且c(NH4+)>c(OH-)>c(NO3-)>c(H+)
16.下列各组离子能在指定溶液中肯定大量共存的是 ( )
①无色溶液中:K+、Na+、Cu2+、Cl-、SO42-
②pH>7的溶液中:CO![]() 、NO3-、Na+、S2-、Al2-、SO32-
、NO3-、Na+、S2-、Al2-、SO32-
③水电离出的c(H+)=10-12mol·L-1的溶液中:HCO3-、NO3-、NH4+、Fe2+
④加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、CO32-
⑤pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
A.②③④ B.①④⑤ C.②⑤ D.③⑤
第Ⅱ卷(非选择题,共60分)
|
现有下列电解质溶液:①Na2CO3 ②NaHCO3 ③ ④CH3COONH4
⑤NH4HCO3
|
(2)已知酸性 。常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号) > >
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH 7(填>、=或<)理由是
|
已知:
在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A B(大于;等于;小于)
达平衡时SO3的转化率A B(大于;等于;小于)
(2)若平衡后,向A、B中分别充入惰性气体, 容器的平衡将向 方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A ,B
|
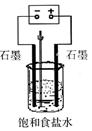
(1)写出电解饱和食盐水的离子方程式
(2)用右图所示装置电解500mL2mol·L-1食盐水可制取一种消毒液,在通电过程中不断搅拌溶液(使阳极产物全部溶解在溶液中)溶液的pH(填写字母)
A.逐渐增大;
B.逐渐减小;
C.保持不变
当阳极有氧气生成时,停止通电最终所得溶液中的溶质主要成分是 ;
假设电解过程中阳极产物无逸出,溶液加水至500mL,消毒液的浓度是 mol·L-1
(3)向上述制取的消毒液中通入CO2气体,可以增强消毒效果,写出反应的离子方程式
20.(共13分)
已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C、含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是A ;B ;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,写出化学方程式
若C为第一和第二周期元素组成的化合物。
①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做
剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
21.(共12分)
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式 ;其中含有的化学键是
(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是(填写化学式):
;
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填写化学式);
;
(4)与Z上下相邻的同主族元素M、N,原子电子层数M>Z>N,三种元素氢化物沸点由大到小的顺序是(填写化学式) > >
(5)元素Y的单质在一定条件下,能与氢气化合生成一种固态氢化物YH,熔点为800℃。
①YH晶体类型是
②YH能与水反应放氢气,写出化学方程式
③若将1molYH和1molAl混合加入足量水中,放出气体的体积是(标准状况下) L。
22.(共14分)
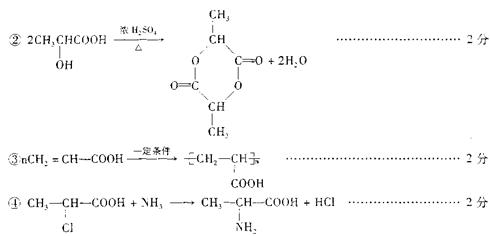
由C、H、O三种元素组成的化合物A,其蒸气密度是相同状态下H2密度的30倍。将30gA充分燃烧,产物被足量烧碱溶液吸收,烧碱溶液增重44g。已知A能与NaHCO3反应生成CO2。回答下列问题
(1)A的结构简式是
(2)有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃
基上的一氯取代产物有3种。C的结构简式是
(3)有机物B在Cu做催化剂的条件下与O2反应生成D,化学方程式是
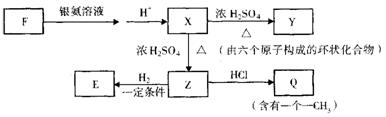
(4)有机物E是D的氧化产物,F是E的一种同分异构体,F有下图所示的转化关系:
|
①写出F的结构简式
②写出由X生成Y的化学方程式
③Z在一定条件下可以聚合,写出化学方程式
④已知NH3和H2O具有相似的化学性质。有机物Q可以发生水解反应,也可以发生氨解反应,写出Q发生氨解反应的化学方程式
参考答案
1.A 2.B 3.D 4.C 5.B 6.C 7.D 8.B 9.C 10.A
11.C 12.D 13.B 14.B 15.C 16.C
17.(共7分)
(1)②④⑤(1分) (2)①>③>②(1分)
|
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
(4)>;理由:因为CH3COONH4溶液呈中性,说明CH3COO-和NH4+水解程度相同;而H2CO3酸性弱于CH3COOH,HCO3-的水解程度大于CH3COO-,因为NH4HCO3溶液pH>7(3分)
18.(共6分)
(1)小于;小于(各1分,共2分)
(2)B;正反应;变小;不变(各1分,共4分)
|
(1)2Cl-+2H2O Cl2↑+H2↑+2OH-(2分)
(2)A;NaClO;(每空1分,共2分) 2(2分)
(3)2ClO-+CO2+H2O 2HClO+CO![]()
20.(共13分)
(1)HCl;H2S;CH4(各1分,共3分)
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890kJ·mol-1(2分)
(3)2PH3+4O2
P2O5+3H2O
|
①2H2O2 2H2O+O2↑(2分)
②氧化剂(2分)
③1:2(2分)
21.(共12分)
(1)Na+[![]() ]2+Na2+;离子键、非极性键(每空1分,共2分)
]2+Na2+;离子键、非极性键(每空1分,共2分)
(2)HClO4(1分)
(3)NH3(1分)
(4)H2O>H2Se>H2S(2分)
(5)①离子晶体(2分)
②NaH+H2O=NaOH+H2↑(2分)
③56(2分)
22.(共14分)
(1)CH3COOH(2分)
(2)CH3COOCH2CH2CH3(2分)
|
![]() (3)2CH3CH2CH2OH+O2
2CH3CH2CHO+2H2O
(3)2CH3CH2CH2OH+O2
2CH3CH2CHO+2H2O
(4)①CH3CHCHO (2分)
|