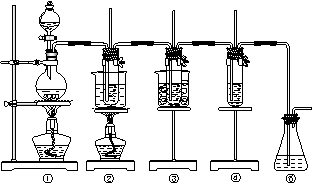
高三化学第一学期期终模拟
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5
Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意。请将符合题意的答案序号统一填写到答题卷中)
1. 2008夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指
A.奥运场馆建设均使用天然材料,不使用合成材料
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品和食品全都是绿色的
D. 把环境保护作为奥运设施规划和建设的首要条件
2.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
A.①③ B.①②③ C.③④ D.②③④
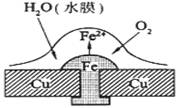 3.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
3.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
A.正极电极反应式为:2H++2e—=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
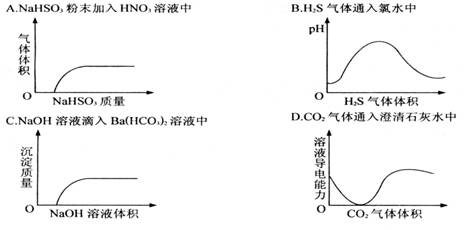
4.下列实验过程中产生的现象与对应的图形相符合的是
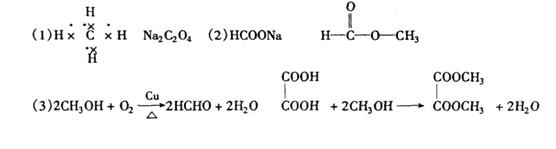
5. X、Y、Z分别是三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):
⑴X + Z → N;⑵M+X → N;⑶ M+Y→ R+X 。若X是非金属,则组成Y单质的元素在周期表中的位置是
A.第二周期ⅣA族 B.第二周期ⅥA族
C.第三周期ⅡA族 D.第三周期ⅣA族
6.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是
A. 已经制得了IBr、ICl等卤素互化物 B. 已经制得了I2O5等碘的氧化物
C. 已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子的离子化合物
D. 碘单质(I2)在通常情况下为具有金属光泽的紫黑色固体
7. 14C是碳的一种同位素,NA为阿伏加德罗常数,下列说法中不正确的是: ( )
A.![]() mol14CH4分子中所含中子数为NA B.7g14C原子形成的石墨中所含质子数为3NA
mol14CH4分子中所含中子数为NA B.7g14C原子形成的石墨中所含质子数为3NA
C.17g甲基(-14CH3)所含电子数为9NA D.常温常压下,22.4L14CO2其分子数为NA
8.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
A.②③④ B.②③④⑤ C.①③④ D.①②③④
二、(本题包括6小题,每小题4分,共24分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选或错选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个该小题就为0分。)
9.一定温度和压强下,下列各可逆反应达到化学平衡状态,各反应有如图所示的对应关系:
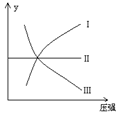 (1)N2(g)+3H2(g)
(1)N2(g)+3H2(g)![]() 2NH3(g);ΔH<0(曲线Ⅰ)
2NH3(g);ΔH<0(曲线Ⅰ)
(2)H2(g)+I2(g)![]() 2HI(g);ΔH>0(曲线Ⅱ)
2HI(g);ΔH>0(曲线Ⅱ)
(3)2SO3(g) ![]() 2SO2(g)
+O2(g);ΔH>0(曲线Ⅲ)
2SO2(g)
+O2(g);ΔH>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是( )
A.平衡混合气中一种生成物的体积分数 B.平衡混合气中一种反应物的体积分数;
C.平衡混合气的平均相对分子质量 D.平衡混合气中一种反应物的转化率
10.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+) >c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+) =c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
11.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O
B.用铜作电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
C.铜片跟稀硝酸反应:Cu+NO3—+4H+ Cu2++NO↑+2H2O
D.铝片和氢氧化钠溶液反应:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
12.生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂。
B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C.某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
13. “魔棒”常被用于晚会现场气氛的渲染。其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
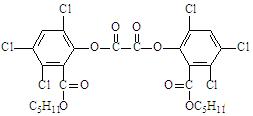
下列有关说法正确的是 ( )
A.草酸二酯属于芳香烃 B.草酸二酯的分子式为C26H23O8Cl6
C.草酸二酯难溶于水 D.1mol草酸二酯最多可与4molNaOH反应
14.常温下,某酸HA溶液和某碱BOH溶液的pH之和为14,两溶液混合后,溶液的pH=7,下列判断中合理的是( )
| 编号 | HA | BOH | 溶液的体积关系 | |||
| ① | 强酸 | 强碱 | V(HA)<V(BOH) | |||
| ② | 强酸 | 强碱 | V(HA)=V(BOH) | |||
| ③ | 强酸 | 弱碱 | V(HA)>V(BOH) | |||
| ④ | 弱酸 | 强碱 | V(HA)>V(BOH) | |||
A.①③ B.②③ C.②④ D.①④
第Ⅱ卷 非选择题(72分)
三、本大题共两题,计20分
15、(10分)氟化钠是一种用于农作物杀菌、杀虫剂和木材的防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
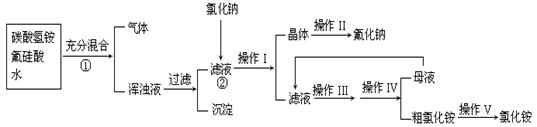
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为2g,Na2SiF6微溶于水:
(1)流程①中H2SiF6和NH4HCO3反应得到的NH4F与H2SiO3组成浑浊液,请写出流程②中相关反应的化学方程式: ;
能够发生上述反应的原因: 。
(2)操作I和IV是相同的,请指出其名称 ;
(3)操作II中洗涤沉淀的过程是将漏斗中母液全部滤出后,
;
(4)流程①中NH4HCO3必须过量,其原因是 。
16、 (10分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
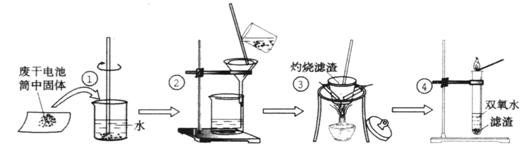 (1) 操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、
、
;
(1) 操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、
、
;
(2) 操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式: ;
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
(一) [猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]: (填“猜想I成立”或“猜想I不成立”);
(二) [猜想II]:主要成分为氯化锌;
[验证(操作)过程]:
;
[实验现象]:
;
[判断猜想]:猜想Ⅱ成立;
由上述实验得出的结论是:滤液中的主次成分:
.
四、本题共两小题,合计21分
17、(10分)钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:
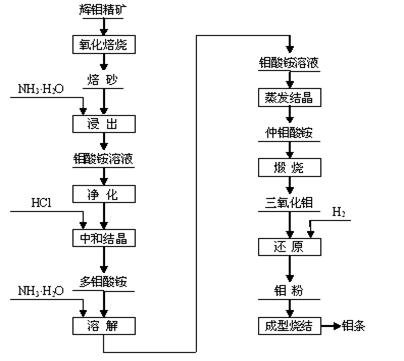
(1).辉钼精矿在600℃下进行氧化焙烧转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。
钼冶炼厂对大气的污染主要来自于SO2气体,工业上处理该物质的主要方法是利用
吸收后再用空气进行氧化,请写出处理过程中相关的化学方程式 、 ;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55~65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O·mMoO3·nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[3(NH4)2O·7MoO3·4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450~650℃下: MoO3 +H2 === MoO2 + H2O
② 在900~950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
18.(11分)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是
; 。(请写两条)
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学化方程式:H2(g)+1/2O2(g) H2O(l) △H=-285.8kJ/mol
C(g)+O2(g)=CO2(g) △H=-393.5kJ/mol
C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
(3)已知:H2(g)=H2(l);△H=-0.92kJ/mol O2(g) O2(l);△H=-6.84kJ/mol
H2O(l)=H2O(g);△H=44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式: 。
如果此次嫦娥一号所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量 kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极: ; 正极: ;
总反应式: 。
五、本题包括2小题(19分)
19.(10分)“C1化学”是指以分子中只含一个碳原子的物质为原料进行物质合成的化学。下图是以天然气的主要成分为原料的合成路线流程图,其中“混合气体”的成分与水煤气相同;B的水溶液有杀菌防腐性能;D是C的钠盐,2mol D分子间脱去1mol H2分子可缩合生成E;H是F与A按物质的量之比为1∶2反应的产物。
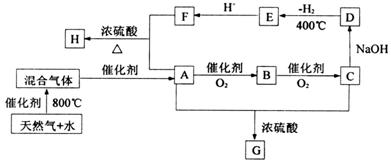
填写下列空白:
(1)天然气主要成分的电子式是 ;E的化学式是 。
(2)D、G的结构简式是D G 。
(3)写出下列反应式的化学方程:
A→B
A+F→H 。
20.(9分)已知两个羟基同时连在同一个碳原子上的结构是不稳定的,它要发生脱水反应:
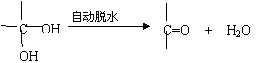
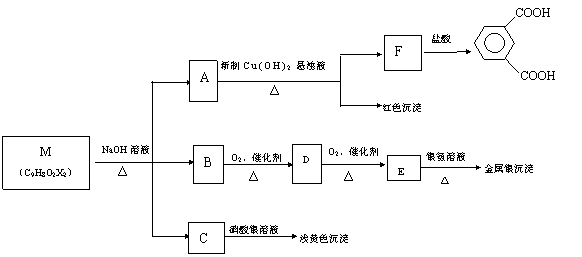 现有分子式为C9H8O2X2(X为一未知元素)的有机物M,可在一定条件下发生下图所示的一系列反应:
现有分子式为C9H8O2X2(X为一未知元素)的有机物M,可在一定条件下发生下图所示的一系列反应:
试回答下列问题:
(1)X为 (填元素符号);
(2)上述转化中其中属于氧化反应的共有 步(填数字);
(3)M的结构简式为 ;
(4)写出A![]() F的化学方程式 。
F的化学方程式 。
(5)M![]() A+B+C的化学方程式
A+B+C的化学方程式
六、选做题(本题包括2小题,每小题12分,考生只能选做一题,若两题均做,只以第一题计算。)
21 A.《物质结构与性质》(12分)
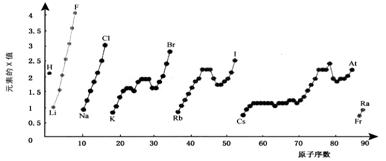 下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
(1)短周期中原子核外p亚层上的电子数与s亚层上的电子总数相等的元素是____(写元素符号)。
(2)同主族内不同元素的X值变化的特点是
________________,同周期内,随着原子序数的增大,X值变化总趋势是_________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_________。a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律 b. X值可反映原子在分子中吸引电子的能力
c. X值大小可用来衡量元素金属性和非金属性的强弱
21B.《实验化学》(12分)
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
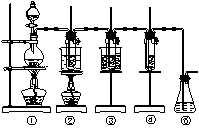
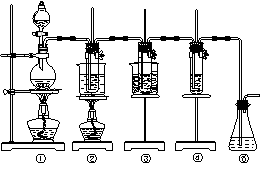 图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液。请填写下列空白:
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液。请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________或_________(填写化学试剂名称)的净化装置。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:______________________________。
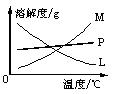 ②的试管中反应的离子方程式为___________________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是________(填写实验操作名称)。
②的试管中反应的离子方程式为___________________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是________(填写实验操作名称)。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,说明使用何种化学试剂,理由________________________________________________________

高三化学期终模拟答题纸
一、选择题答题处(1-8题每题3分,9-14题每题4分,共48分):
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
三、本大题两大题,共20分
15、(10分)(1) ;
原因:
(2) ;
(3) ;
(4) 。
16、(10分)(1) 、 ;
(2) ;
(3) ;
(4)(一)[判断猜想]: 。
(二)[验证(操作)过程]:
;
[实验现象]:
;
滤液中的主次成分:
四、本题共两小题,合计21分
17、(10分)(1) ;
、
(2) ;
(3) ;
18、(11分)(1) ;
(2) 、
(3) 。
(4)负极: ;正极
总反应式:
五、本题共二题,共19分
19、(10分)(1) ;
(2)D G
(3)A→B
A+F→H
20、(9分)(1) (2) (3)
(4)A→F
(5)M![]() A+B+C的化学方程式
A+B+C的化学方程式
六、选做题(12分)(只选做一题,若两题均做,只以第一题计算。)
21A.《物质结构与性质》(12分)
(1)
(2) ,
 ,
,
(3)
(4)
21B.《实验化学》(12分)
(1) 或
(2) 。
。
, 。
(3)现象: 色,
(4)
高三化学期终模拟参考答案
1. D 2、D 3、A 4、D 5、C 6、C 7、D 8、D
9、AD 10、CD 11、AD 12 C 13、C 14、B
15、(10分)(1) ② NH4F+NaCl==NaF↓+NH4Cl (2分);NaF 的溶解度比NH4F的溶解度小得多(2分) (2)过滤(2分)
(3)再在滤纸上加蒸馏水至恰好浸没晶体,静置让其滤出,重复操作2-3次,以除去晶体表面的杂质(2分)
(4)必须保证①中H2SiF6能全部反应,防止导致②中生成Na2SiF6沉淀(2分)
16、(10分)(1)坩埚、三角架(或坩埚钳、泥三角等)(各1分共2分)
(2)方程式略(1分) (3) 炭(或碳、或C) (1分)
(4) (一):[判断猜想]:猜想I不成立 (1分)
(二):[验证(操作)过程]:取少量滤液逐滴滴入稀氨水( 1分)
[实验现象]:先有白色沉淀、滴入过量稀氨水后白色沉淀溶解(2分);
[判断猜想]:结论:主要为氯化锌,其中含少量的氯化铵(2分。)
[若说成氯化铵和氯化锌的混合物给1分;若说成只有氯化锌没有氯化铵0分]
17.(本题共10分)(1)2MoS2 + 7O2= 2MoO3 + 4SO2 (2分) ;
SO2(1分) ;石灰水(或氨水)(1分)方程式略(各1分合计2分)
(2)MoO3+2NH3·H2O=2NH![]() + MoO
+ MoO![]() +H2O (2分) ; 不是(1分)
+H2O (2分) ; 不是(1分)
(3)CO(1分)
18.(11分)(1)相同质量时,氢气放出的热量多(1分);产物为水,无污染(1分)
(2)H2(1分),4.4:1(1分)
(3)H2O(l)+1/2O2(l) H2O(g);△H=-237.46kJ/mol(2分) 5.94×108(2分)
(4)负极:2H2+4OH—-4e— 4H2O(1分)正极:O2+2H2O+4e— 4OH—(1分)
总反应式:2H2+O2 2H2O(1分)
 19.第(1)题每空1分,其余每空2分,共10分)
19.第(1)题每空1分,其余每空2分,共10分)
20.(9分) (1)Br (1分) (2)4(2分) (3) (2分)
![]()
![]() (4)
+2Cu(OH)2
(4)
+2Cu(OH)2![]() +Cu2O↓+2H2O (2分)
+Cu2O↓+2H2O (2分)
(5)
21A(1)O,Mg(2分);
(2)同一主族,从上到下,X值逐渐减小(1分);逐渐增大(1分);周期性(1分);
(3)a(2分);(4)bc(3分)
21B. (1) _饱和食盐水 1’或稀盐酸 1’(填写化学试剂名称)
|
![]() _3Cl2
+ 6OH—
ClO3— + 5Cl—+3H2O 2’ _。
_3Cl2
+ 6OH—
ClO3— + 5Cl—+3H2O 2’ _。
_M__1’__(填写编号字母); _过滤 1’_
(3) 溶液最初从紫色逐渐变为_红_ 1’_色
氯气与水反应生成HClO将石蕊氧化成无色物质 1’
(4)理由用氢氧化钠溶液吸收尾气,防止污染空气。1’
|