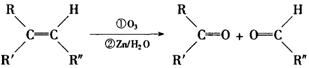
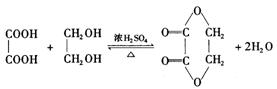
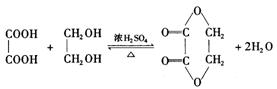
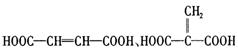高三化学第一学期第五次月考试题
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共110分。考试时间110分钟。
原子量:H:1 C:12 N:14 O:16 Na:23 Fe:56 Al:27 Mg:24 S:32 Cu:64 Ba:137
注意事项:
1.本试卷分为选择题和非选择题两部分,共15页。
2.答卷前,考生务必将自己的姓名、座号、准考证号分别填写在答题卡及答题纸上。
3.选择题的每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号,不能答在试卷上。
4.考试结束后,将答题卡和答题纸一并交回。
第Ⅰ卷(选择题 共50分)
一、选择题(下列每小题所给选项只有1个选项符合题意,每小题1分,共10分。)
1.下列各项是关于玻璃棒在若干实验中的用途及操作,其中错误的是:( )
①溶解物质时搅拌 ②蘸取少量溶液测其pH值 ③加热坩埚中固体物质时用玻璃棒搅拌 ④过滤时用玻璃棒引流,其下端在漏斗内滤纸的任意部位⑤配制一定体积的物质的量浓度的溶液用玻璃棒引流
A.③④⑤ B.④⑤ C.只有④ D.全部
2.下列实验操作会引起结果偏高的是 ( )
A.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却
B.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
C.用质量分数分别为10%的硫酸溶液和90%的硫酸溶液等体积混合配制50%的硫酸溶液
D.配制物质的量浓度的溶液,定容时仰视刻度线
3.1,4-二氧六环是一种常见的溶剂,它可以通过下列方法合成
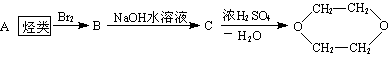
则烃A为 ( )
A.1-丙烯 B.1,3-丁二烯 C.乙炔 D.乙烯
4.据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C—C≡C—C≡C—C≡N对该物质的判断不正确的是 ( )
 A.其分子中的原子都在一条直线上 B.能使酸性高锰酸钾溶液褪色
A.其分子中的原子都在一条直线上 B.能使酸性高锰酸钾溶液褪色
C.能发生加成反应 D.可由乙炔和含氮化合物加聚制得
5.右图是制取和收集某气体的实验装置,该装置可用于( )
A.用浓盐酸和二氧化锰反应制取Cl2
B.用浓氨水和生石灰反应制取NH3
C.用浓硝酸与铜反应制取NO2
D.用过氧化钠固体和水反应制取O2
6.体积相同的两个容器中,一个盛有N2O、另一个盛有C3H8,在同温同压下两容器内的气体一定不相同的是 ( )
A.原子数 B.分子数 C.质量 D.密度
7.设NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
B.标准状况下,2.24 L 乙醛完全燃烧所得CO2分子数为0.2 NA
C.1L0.1mol/L的醋酸溶液中的溶质分子总数小于0.1NA
D.通过化学反应制得1molO2,转移电子的数目一定是4NA
8.用右图表示的一些物质或概念间的从属关系中不正确的是( )
| X | Y |
| |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
9.常温下,将pH=2的盐酸与pH=13Ba(OH)2溶液混合后,所得溶液的pH=11,则盐酸与Ba(OH)2溶液的体积比为( )
A.1:11 B.11:1 C.1:9 D.9:1
10.判断下列有关化学基本概念的依据正确的是( )
A.氧化还原反应:元素化合价是否变化 B. 共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小 D. 金属晶体:晶体是否能够导电
二、选择题(下列每小题所给选项有1个或2个选项符合题意,每小题2分,共40分。)
 11.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
11.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
A.N4属于一种新型的化合物 B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高 D.1mo1N4气体转变为N2将放出882kJ热量
12.以下实验装置一般不用于分离物质的是( )
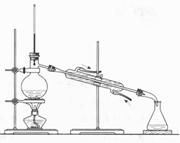 | |||||||
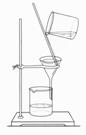 | |||||||
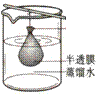 | |||||||
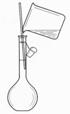 | |||||||
A. B. C. D.
13.下列叙述正确的是( )
A.原子晶体中只存在非极性共价键
B.干冰升华时,分子内共价键会发生断裂
C.由原子构成的晶体可以是原子晶体,也可以是分子晶体
D.只要含有金属阳离子的晶体就一定是离子晶体
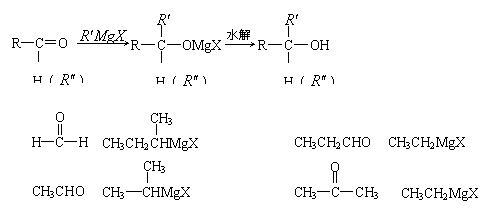 14.已知醛和酮可与格氏试剂(
14.已知醛和酮可与格氏试剂(![]() )发生加成反应,所得产物经水解可得醇:
)发生加成反应,所得产物经水解可得醇:
若要用此种方法制取HOC(CH3)2CH2CH3,可选用的醛(或酮)与格氏试剂是( )
A. 与 B. 与
C. 与 D. 与
15.下列热化学方程式中,能够表示物质燃烧热的是( )
A.C(s)+1/2O2(g)=CO(g);![]()
![]() H=-110.5kJ/mol
H=-110.5kJ/mol
B.H2(g)+Cl2(g)
=2HCl(g);![]()
![]() H=-184.6kJ/mol
H=-184.6kJ/mol
C.H2(g)+1/2O2(g)= H2O(g);![]()
![]() H=-241.8kJ/mol
H=-241.8kJ/mol
D.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l); ![]() H=-5518kJ/mol
H=-5518kJ/mol
16.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列能够支持这个结论的是( )
A.已经制得了I2O5等碘的氧化物
B.在IBr、ICl等卤素互化物中碘元素表示正价
C.已经制得了I(NO3)3、I(ClO4)3•2H2O等离子化合物
D.碘(I2)易溶于碘化钾等碘化物溶液,形成I3-离子
17.下列各组离子中,在无色透明的酸性溶液中,可以大量共存的是( )
A.Al![]() 、Na
、Na![]() 、SO
、SO![]() 、Br
、Br![]() B.Na
B.Na![]() 、NH
、NH![]() 、NO
、NO![]() 、I
、I![]()
C.K![]() 、Mg
、Mg![]() 、Fe
、Fe![]() 、Cl
、Cl![]() D.Na
D.Na![]() 、AlO
、AlO![]() 、SO
、SO![]() 、CO
、CO![]()
18.如下表所示,为提纯下列物质(括号内为杂质)所用的除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
19.由以下五种基团两两结合而形成的化合物,能与NaOH溶液反应的共有( )
① —CH3 ② —OH ③ —C6H5 ④ —CHO ⑤ —COOH
A.3种 B.4种 C.5种 D.6种
20.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
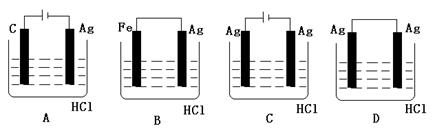
![]() 21.中草药秦皮中含有七叶树内酯,其结构式如右图:
(C、H原子未画出,每个折点代表一个碳原子),具有抗菌作用,若1mol的七树内酯分别与浓Br2水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
21.中草药秦皮中含有七叶树内酯,其结构式如右图:
(C、H原子未画出,每个折点代表一个碳原子),具有抗菌作用,若1mol的七树内酯分别与浓Br2水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
A.3mol Br2;2mol NaOH B.3mol Br2;4mol NaOH
C.2mol Br2;2mol NaOH D.4mol Br2;4mol NaOH.
22.己烯雌酚是一种激素类药物,结构如下。下列有关叙述中不正确的是( )
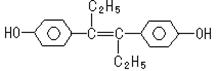 A.它易溶于有机溶剂
A.它易溶于有机溶剂
B.1mol该有机物可以与7mol Br2发生反应
C.可与NaOH溶液反应
D.该有机物分子中,一定有14个碳原子共平面
23.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是( )
A.X肯定为碱金属元素 B.Y、Z两元素形成的化合物熔点较低
C.X、Y两元素形成的化合物可能为离子晶体 D.稳定性:Y的氢化物>Z的氢化物
24.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
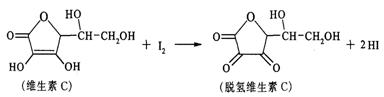
下列说法正确的是( )
A.上述反应为取代反应 B.维生素C在酸性条件下水解只得到1种产物
C.维生素C的分子式为C6H8O6 D.维生素C不可溶于水,可溶于有机溶剂
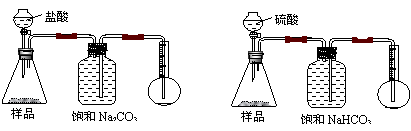 25.我国青海湖地区素有“夏天晒盐,冬天捞碱”之说。其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。某同学以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量,下列装置中正确的是
(
)
25.我国青海湖地区素有“夏天晒盐,冬天捞碱”之说。其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。某同学以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量,下列装置中正确的是
(
)
A B


|
C D
26.下列离子反应方程式书写正确的是( )
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢注入10mL 1mol/L的FeBr2溶液中:
2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
D.向苯酚钠溶液中通入少量CO2气体 :C6H5O- + CO2 + H2O—→C6H5OH + HCO3-
27.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是 ( )
 A.一氯代物的同分异构体只有三种
A.一氯代物的同分异构体只有三种
B.分子中含有二个亚甲基(—CH2—)
C.分子中含有4个五元碳环
D.分子式为C20H20
28.T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B和C物质的量变化与时间关系如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是( )
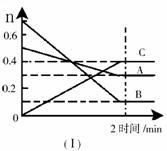
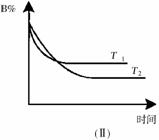
A.2min内A的化学反应速率为0.1mol/L•min
B.在反应达到平衡时,保持其它条件不变,增大压强,正逆反应速率都增大,
且平衡向逆反应方向移动
C.在反应达到平衡时,保持其它条件不变,升高温度,正逆反应速率都增大,
且A的转化率增大
D.在T℃时,若A的浓度减少了1mol/L,则B的浓度会减少3mol/L,C的浓度会增加2mol/L
29.下列说法正确的是( )
A.某二元弱酸的酸式盐NaHA溶液中: c(H+)+c(A2-)=c(OH-)+c(H2A)
B.0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合得到碱性混合溶液中:
c(Na+)> c(CN-)
C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:
c(CH3COOH)+c(CH3COO-)=0.01 mol/L
D.c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:
c[(NH4)2SO4] > c(NH4HCO3) > c(NH4Cl)
30、已知两个醛分子在NaOH溶液的作用下可以发生自身加成反应,生成一种羟基醛如图:
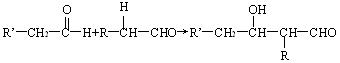
若两种不同的醛,例如乙醛和丙醛在NaOH溶液中最多可形成多少种单羟基醛( )
A、1种 B、2种 C、3种 D、4种
卷Ⅱ(非选择题 共60分,答案写在答题纸上)
31.(3分)下列有关化学实验的基本操作及安全知识的叙述,错误的是________.(填序号)。
A.用托盘天平称取10.50 g干燥的NaCl固体
B.中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒
C.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.采取降温结晶可以提纯混有少量氯化钠的硝酸钾
F.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
32.(7分)某有机物A的分子式为CXHYOZ ,4.4gA完全燃烧生成8.8gCO2和3.6gH2O
(1)该有机物的实验式(最简式)为 。
(2)已知有机物分子中碳碳双键上不连羟基,分子量最小的A的结构简式为
(3)若A是一种能发生银镜反应且含羟基的有机物,则分子量最小的A的结构简式有 种
(4)若A 能与碳酸钠溶液反应放出气体,与醇发生酯化反应,则分子量最小的A的结构简式为(有多少种写多少种)
(5)能发生水解反应,也能发生银镜反应的分子量最小的A的结构简式为(有多少种写多少种)
33.(8分)2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应符合“绿色化学”思想的是
![]() A.制备环氧乙烷:
A.制备环氧乙烷:
![]() B.制备硫酸铜:Cu+2H2SO4
B.制备硫酸铜:Cu+2H2SO4![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN—有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN—氧化为CO32—和一种无毒气体,该反应的离子方程式为
在酸性条件下,ClO—也能将CN—氧化,但实际处理时却不在酸性条件下进行的主要原因是:
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 |
|
| 乙烯 | 来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
从产率和产量角度分析
。
从环境保护和能耗角度分析
。
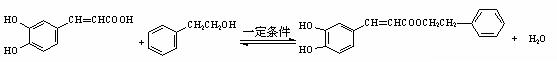
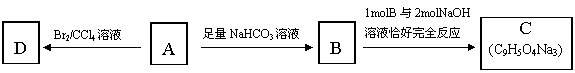 34.(7分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
34.(7分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
(1)咖啡酸中含氧官能团的名称为___________________________。
(2)咖啡酸不能发生的反应是__________ (填写序号)。
① 氧化反应 ② 加成反应 ③ 酯化反应 ④ 加聚反应 ⑤ 消去反应
(3)咖啡酸可看作1,3,4—三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为_______________________________。
(4)3.6 g咖啡酸与足量碳酸氢钠反应生成气体(标准状况)_______ mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为_______________________________________________ ___
35. (9分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
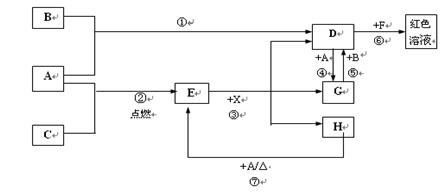
(1)写出下列物质的化学式: D___________; X____________;
(2)在反应①~~⑦中,不属于氧化还原反应的是______(填编号)。
(3)反应⑥的离子方程式为:__________ ____ __
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为________________________ _;
该反应中每消耗0.3 mol的A,可转移电子_______________mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为_______________ ___。
36.(8分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图所示:
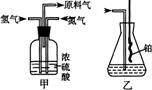
 请回答以下问题:
请回答以下问题:
实验开始时,仪器A中盛放电石,
B中应装入 ,
其作用是:
仪器D中盛放水,其作用是:
蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称: ,将HgO加入F中的操作方法是
。
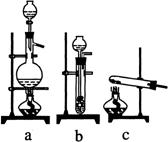
装置图中,加热F的方式叫 ,所选用温度计的量程表示正确的是 (填代号)。
A.00C~500C B.00C~1000C C.00C~2000C D.500C~1000C E.00C~3600C
写出乙醛银镜反应的化学方程式
 37.(11分)实验室模拟合成氨和氨催化氧化的流程如下:
37.(11分)实验室模拟合成氨和氨催化氧化的流程如下:
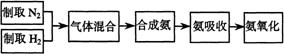
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:
氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体
混合外,还有 、
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,
锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
38.(7分)已知一定条件下,烯烃可发生下列反应:
|
现有如下转化关系,其中A是蜂王浆中的有效成分,分子式为C10H18O3,具有酸性。B 能被NaOH溶液中和。C中没有支链,也不含—CH3。G是六元环状化合物,分子式为C4H4O4。
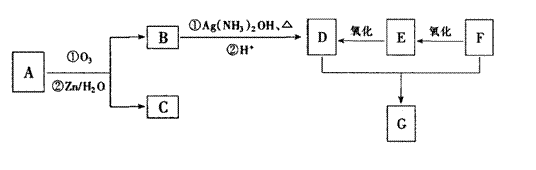 |
请回答:
(1)B中的结构简式为 。
(2)E与足量的新制氢氧化铜悬浊液反应的化学方程为:
。
(3)D与F反应生成G的化学方程式为 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有:
(写结构简式)。
(4)A的结构简式为
A的加聚产物是一种功能高分子材料,其结构简式为
高三化学答案
1C2C3D4D5D6A7C8C9D10A11D12A13C14D15D16C17A18C19D20C
21B22BD23BC24BC25B26D27AD28D29B30D
31.(3分)
A、B、F(每选对1个得1分,选错1个倒扣1分,最多扣完该题得分为止。)
32.(7分)
(1)C2H4O (1分) (2)CH3CHO (1分) (3)5种 (1分)
(4)CH3CH2CH2COOH (1分) (CH3)2CHCOOH (1分)
(5)HCOOCH2CH2CH3 (1分) HCOOCH(CH3)2 (1分)
33.(8分 )
(1)A C(2分)
(2)5ClO—+2CN—+2OH—=2CO32—+N2↑+5Cl—+H2O,(1分)
在酸性条件下,CN—与H+结合生成毒性很强的HCN,对人和环境造成危害。(1分)
(3)①虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比乙炔高得多;(2分)
②乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;
乙炔的制取要经过多步反应制得,且消耗大量的热能、电能。
乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得。(2分)
34.(7分)
(1)羧基 、羟基 (2分)
(2)⑤(1分)
 |
(3) (1分)
(4)448 (1分)
(5) (2分)
35.(9分)
(1) FeBr3(1分); HBr(1分) (2)③⑥(各1分,共2分)
(3)Fe3+ +3SCN-=Fe(SCN)3;(1分,其他正确写法也给分);
(4)生成的沉淀由白色变为灰绿色最终变为红褐色。(1分)
(5)3Fe+4H2O(g)![]() Fe3O4+4H2↑(1分) 0.8(1分)
Fe3O4+4H2↑(1分) 0.8(1分)
(6)Fe3++3HCO3-= Fe(OH)3↓+3CO2↑ (1分)
36.(8分)
NaOH溶液 (1分)
除去乙炔中的H2S杂质,避免在后续实验中所使用的催化剂HgSO4中毒 (1分)
吸收生成的乙醛蒸气 (1分)
氧化汞、水、浓硫酸 (1分)
将蒸馏烧瓶横置,用药匙或纸槽将HgO送入烧瓶底部,再慢慢竖立 (1分)水浴 (1分) B (1分)
![]() (1分)
(1分)
37.(11分)
(1)a、b (2分) (2)干燥气体 (1分) 控制氢气和氮气的流速(1分)
(3)不会(1分) 因为混合气体中含有大量难溶于水的氮、氢两种气体(1分)
(4)说明氨的氧化反应是一个放热反应 (1分)
有红棕色气体产生(1分)
(5)4NH3十5O2![]() 4NO+6H2O(1分)
4NO+6H2O(1分)
(6)NH4+
(1分) NO3-(1分)
38. (7分)(每个1分)
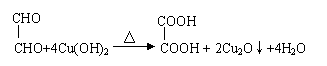 (1)
(1) ![]()
|
(2)
(3)
|
 |
(4) HOCH2-(CH2)6-CH=CH-COOH;
 Z
Z