高三化学第一学期质量检测试题
化 学 试 题
第Ⅰ卷(选择题 共56分)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Al—27 Si—28 Fe—56
Cu—64 Zn—65 Ag—108 Ba—137
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列关于普通玻璃的叙述中,正确的是 ( )
A.它是人类是早使用的硅酸盐材料 B.红色玻璃中含氧化亚铜
C.它在加热熔化时有固定的熔点 D.无色玻璃是纯净物
2.下列玻璃容器不能用括号中对应试剂清洗的是 ( )
A.做银镜反应后的试管(稀硝酸)
B.碘升华实验后的烧瓶(氢氧化钠溶液)
C.久置石灰水后的试剂瓶(稀盐酸)
D.高锰酸钾制氧气后的试管(稀盐酸)
3.铁是人类较早使用的金属之一,据有关报道,目前已能冶炼纯度高达99.999 9%的铁。下列关于它的性质说法不正确的是 ( )
A.在冷的浓硝酸中钝化 B.在潮湿的空气中放置不易生锈
C.不能与稀硝酸反应 D.硬度比生铁低
4.下列反应合乎实际并用于工业生产的是 ( )
A.金属钠在氯气中燃烧制氯化钠
B.铝热反应制取金属镁
C.氢气和氯气混合后经光照制氯化氢
D.氯气和石灰乳作用制漂白粉
|
|
|
|
D.2Ag2O 4Ag+O2↑
6.在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则。下列说法不正确的是 ( )
A.锂在空气中燃烧,产物有氧化锂
B.铍能和氢氧化钠溶液反应生成氢气
C.硼的含氧酸盐能形成玻璃类物质
D.氮气和硫的化学性质均十分稳定
7.下列离子方程式正确的是 ( )
A.少量的NaHSO4和Ba(OH)2溶液反应:2H++SO42—+Ba2++2OH— BaSO4↓+2H2O
B.NH4HCO3和过量的NaOH溶液相混合:HCO3—+OH— CO32—+H2O
C.NaHSO4溶液中滴加少量NaHCO3溶液:H++HCO3— H2O+CO2↑
D.用氨水吸收少量的SO2:NH3+H2O+SO2 NH4++HSO3—
8.在四只烧杯中,分别盛有相同浓度、相同体积的稀盐酸,现分别向各烧杯中加入足量的下列物质。经充分反应后,生成溶液的物质的量浓度最小的是 ( )
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给满分,但只要选错一个该小题就为0分。)
9.向含有下列各组金属阳离子的硝酸盐中逐滴加入过量的氨水后,能利用过滤操作将反应后的混合物进行分离的是 ( )
A.Cu2+、Fe3+ B.Mg2+、Al3+ C.Na+、K+ D.Ag+、Al3+
|
A.SiO32— B.CO32— C.SO42— D.ClO—
11.下列关于溶液中离子检测说法一定正确的是 ( )
A.加入稀盐酸产生无色并能使澄清石灰水浑浊的气体,一定有CO32—或SO32—
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42—或Ag+
C.加入氢氧化钠溶液产生能使湿润红色石蕊试纸变蓝的气体,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+或Ca2+
|
| a | b | c | d | |
| A | Cl— | K+ | CO32— | HCO3— |
| B | K+ | CO32— | Cl— | HCO3— |
| C | K+ | CO32— | HCO3— | Cl— |
| D | K+ | HCO3— | Cl— | CO32— |
13.向60mL 1mol/L HCl和1mol/L AlCl3的混合溶液中,逐滴加入1mol/L的NaOH溶液,当生成的沉淀的质量为1.5g时,消耗NaOH的体积可能为 ( )
A.60mL B.120mL C.220mL D.280mL
|
14.莽草酸(Shikimic acid) 在生物合成氨草酸、类固醇的过程中扮演着非
|
。1mol Shikimic acid和1mol chorismic acid完全中和时分别消耗NaOH
( )
A.4mol、3 mol B.1mol、2mol C.1mol、3mol D.1 mol、4 mol
15.偏二甲基肼(CH3)2NNH2及N2O4(均为液体)的燃料/氧化剂体系常被用于空间飞行器的推进燃料。现将这两种物质混合,得到的产物只有N2、CO2和H2O(g)。1mol(CH3)2NNH2完全进行上述反应得到气体的总物质的量为 ( )
A.5mol B.7mol C.9mol D.11mol
16.在一定的浓度和温度下,HNO3与Fe反应后得到的还原产物为NO2和NO,它们的物质的量之比为1:3。1mol Fe消耗HNO3的物质的量可能为 ( )
A.2.6mol B.2.8mol C.4.0mol D.6.0mol
|
三、(本题包括1小题,共16分)
17.六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3及⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,他能成功吗? (填“能”或“不能”)
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ;有一组在混合时,随着试剂滴加后的时间不同而出现明显不同的现象,该组是 ,其中涉及氧化还原应的化学方程式为
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
。
(4)实际上实验室配制的FeSO4溶液不可长期保存,短期保存时可在FeSO4溶液配制时加入少量的上述 (填编号)防止水解,若能再加上 (填物质名称)效果会更好。实验室由FeSO4溶液得到晶体的实验操作为
,为了提高硫酸亚铁晶体在空气中的稳定性,实验时常在FeSO4溶液中加入一定量的(NH4)2SO4晶体,试分析(NH4)2SO4提高FeSO4在空气中稳定性的原因 。
四、(本题包括2小题,共24分)
18.下图中,A、E、G在常温下为气态非金属单质,B、L为短周期金属单质,D、I分子
中均含有10个电子,其中I是一种重要的能源。C是由两种常见元素组成的化合物,K是一种由金属氧化物组成的耐高温材料,J是一种非常稀有的矿石,它由三种元素组成,原子个数比为3:1:6,在K电解时J能降低K的熔点。
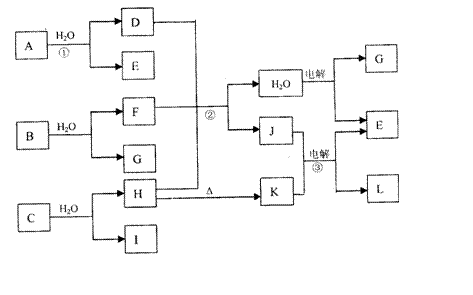 |
请按要求回答:
(1)写出C的化学式 ,F的电子式 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 。
(4)反应③的阳极反应式为 。
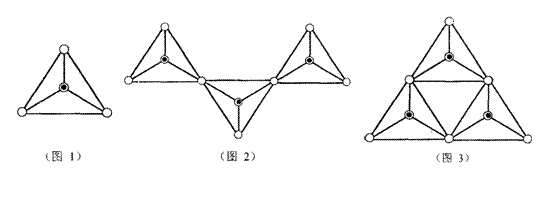 19.硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1,图中○表示“O”,⊙表示“Si—O”),[SiO4]单元既可以是分立的,也可以和其它四面体共用顶点连接各种各样的链状结构(如图2)、环状结构(图3)
19.硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1,图中○表示“O”,⊙表示“Si—O”),[SiO4]单元既可以是分立的,也可以和其它四面体共用顶点连接各种各样的链状结构(如图2)、环状结构(图3)
(1)形成硅氧四面体是硅与氧成键的一个重要特征,试再举两种含有[SiO4]单元的物质(要求不同种类) 。
(2)最简单的硅酸盐是硅酸钠,硅酸钠溶液中滴入酚酞显红色。试用离子方程式解释酚酞变红的原因 ,通入CO2能使上述溶液的红色褪色,离子方程式
。
(3)将某些盐混进硅酸钠溶液时,此盐会向上扩散长成很漂亮的树状,且此树会保留金属离子的特征颜色,例如CuSO4·5H2O和Na2SiO3溶液发生水解反应长成蓝色的树,NiSO4·7H2O则会长成绿色的树,写出加入CuSO4·5H2O长成蓝树的离子方程式 。
(4)图1为SiO44—,图2、图3所示硅酸盐离子的符号 、
(5)由13个正四面体结合成的环状结构Si13O3722—离子中,其中有 个正四面体和另外的四面体共享2个顶点、 个和另外的四面体共享3个顶点。
五、(本题包括2小题,共24分)
20.锰化学丰富多彩,但锰的三价化合物并不多见,某化学活动小组用高锰酸钾、草酸晶体
(H2C2O4·2H2O)和碳酸钾为主要原料合成三草酸锰(Ⅲ)化钾K3[Mn(C2O4)3]晶体。
反应原理:2MnO4—+8H2C2O4=2Mn2++10CO2↑+3C2O42—+8H2O
H2C2O4+CO32—=C2O42—+CO2↑+H2O
4Mn2++MnO4—+11C2O42—+4H2C2O4=5[Mn(C2O4)3]3—+4H2O
实验步骤:
①将0.057mol H2C2O4·2H2O放入盛有45mL水的烧杯中,水浴加热使草酸溶解。
②边搅拌边缓慢加入0.01mol KMnO4,继续水浴加热。
③当该混合物变成无色时,少量分批慢慢加入0.009mol K2CO3。
④冰水浴中充分冷却后,在强烈搅拌下,少量多次加入0.002mol KMnO4,全部加完之后,继续搅拌10分钟,将出现的白色沉淀物过滤掉,用烧杯收集滤液,并以冰水浴冷却。
⑤向滤液中加入35mL经冰冷却的乙醇,用铝箔纸包住烧杯,并置于冰中冷却两小时。
⑥过滤⑤所得的鲜红色的三草酸锰(Ⅲ)化钾晶体,干燥,保存于棕色试剂瓶中。
回答问题:
(1)写出25Mn的基态原子的电子排布式 ;
(2)实验步骤②反应进行的速度是很慢的,但可被Mn2+催化,设计一个实验加以验证
;
(3)实验步骤④中使用冰水浴冷却的原因主要是由天三草酸锰(Ⅲ)化钾 ;
(4)实验步骤⑤中乙醇的作用 ;
(5)铝箔纸包住烧杯冷却及用棕色瓶保存是由于三草酸锰(Ⅲ)化钾 ;
(6)三草酸锰(Ⅲ)化钾的理论产量为 mol,剩余的离子恰好组成步骤④中出现的白色沉淀物,其化学式为 。
21.某天然碱可看作是由二氧化碳和氢氧化钠反应后的产物组成的纯净物。称取该天然碱样
品2.50g,用经煮沸的蒸馏水配成250mL样品溶液。为分析其组成,做了以下两个实验:
①取25.00mL样品的溶液注入锥形瓶中,加2滴甲基橙,用盐酸溶液滴定,直至黄色溶液恰好变为橙色,消耗0.1000mol/L的盐酸35.00mL。
②取25.00mL样品溶液注入锥形瓶中,加入30.00mL 0.1000mol/L的氢氧化钡溶液,再加入2滴酚酞溶液,用0.1000mol/L的盐酸滴定过量的氢氧化钡,消耗盐酸的体积为45.00mL(滴定时沉淀碳酸钡不会溶解)。
(1)写出实验②中,样品溶液与氢氧化钡溶液反应的化学方程式。
(2)试分析计算样品溶液中Na2CO3、NaHCO3的物质的量的浓度
(3)求该天然碱的化学式
参考答案
|
|
17.(16分)(1)能 (2分)
(2)⑤和⑥;①和⑥,4Fe(OH)2+O2+2H2O=4Fe(OH)3(4分)
(3)①、②、⑤:3Fe2++4H++NO3—=3Fe3++NO↑+2H2O
①、②、④:2Fe2++2H++H2O2=2Fe3++2H2O
①、④、⑥:2 Fe2++4OH—+H2O2=2Fe(OH)3↓(4分)
(4)②(1分),几枚铁钉(1分)。蒸发浓缩,冷却结晶(2分)。(NH4)SO4显酸性,抑制FeSO4水解,二价铁在酸性条件下比碱性条件下稳定(2分)。
|
18.(10分)(1)Al4C3(2分),
(2)2F2+2H2O=4HF+O2↑(2分)
(3)6HF+3NaOH+Al(OH)3=Na3AlF6+6H2O(2分)
(4)2O2—-4e—=O2↑(2分)
19.(14分)(1)SiO2或H4SiO4或其它合理答案(2分)
![]() (2)SiO32—+2H2O H2SiO3+2OH—(2分)
(2)SiO32—+2H2O H2SiO3+2OH—(2分)
2CO2+2H2O+SiO32—=2HCO3—+H2SiO3↓(2分)
(3)Cu2++CO32—+2H2O=Cu(OH)2↓+H2SiO3↓(2分)
(4)Si3O108—(2分),Si3O96—(2分)(漏电荷各扣1分)
(5)9个(1分),4个(1分)
20.(14分)(1)1s22s22p63s23p63d54s2或[Ar]3d54s2(2分)
(2)取两支试管分别加入等量的高锰酸钾溶液和草酸溶液,向其中一支试管中加入一粒黄豆大的硫酸锰固体,记录溶液褪色的时间,结果发现加入固体硫酸锰的溶液褪色时间明显少。(2)
(3)对热极不稳定(2分)
(4)降低三草酸锰(Ⅲ)化钾的溶解度(2分)
(5)对光不稳定(2分)
(6)0.01mol,(2分) MnC2O4(2分) 将题的数据加以整理,可得反应③时,
n(Mn2+)=0.01mol, n(MnO4—)=0.002mol, n(H2C2O4)=0.008, n(C2O42—)=0.024mol,可判断出MnO4—、H2C2O4能完全反应完,n([Mn(C2O4)3]3—)=5n(MnO4—)=0.01mol,而Mn2+、C2O42—均剩余0.002mol,刚好结合生成0.002mol MnC2O4
21.(10分)(1)Na2CO3+Ba(OH)2=BaCO3↓+2NaOH(2分)
NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O(2分)
或2Na2CO3+3NaHCO3+5 Ba(OH)2= 5BaCO3↓+7NaOH+3H2O(4分)
(2)c(Na2CO3)=0.04mol/L c(NaHCO3)=0.06mol/L〖提示〗设Na2CO3、NaHCO3的物质的量的浓度分别为x mol/L、y mol/L,由实验①得:25(2x+y)=0.1×35
由实验②得:0.1×45+25y=30×0.1×2 解之得:x=0.04mol/L y=0.06mol/L(4分)
(3)2Na2CO3·3NaHCO3·2H2O
〖提示〗结合c(Na2CO3)=0.04mol/L c(NaHCO3)=0.06mol/L和样品总质量为2.5g,可求出样品中Na2CO3、NaHCO3、H2O的物质的量分别为0.01mol、0.015mol、0.01mol(2分)