高三化学每日一练试题
一、选择题
1、离子检验的常用方法有三种:
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
下列离子检验的方法不合理的是
A NH4+-气体法 B I--沉淀法
C Fe3+-显色法 D Ca2+-气体法
2、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A H2+2OH-=2H2O+2e- B O2+4H++4e-=2H2O
C H2=2H++2e- D O2+2H2O+4e-=4OH-
3、用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是
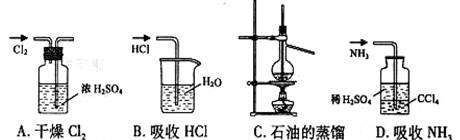 |
4、一定体积的KMnO4溶液恰好能氧化一定质量的
KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
5、三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 ![]() 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 ![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol D.反应中NO2是还原剂
6、.能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应 CH3COO—+H3O+=CH3COOH+ H2O
B.碳酸氢钙与过量的NaOH溶液反应
Ca2++2HCO3—+2OH—=CaCO3↓+ 2H2O+ CO32—
C.苯酚钠溶液与二氧化碳反应 C6H5O—+ CO2+ H2O=C6H5OH+CO32—
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3—=3Fe3++2NO↑+4 H2O
7、在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
8、某学生设计了一个"黑笔写红字"的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
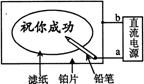
A 铅笔端作阳极,发生还原反应
B 铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生
D a点是负极,b点是正极
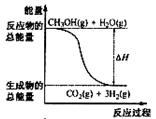 9、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
9、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
10、阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3 ×6.02×1023
B.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5 SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
11、短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍· 下列叙述中不正确的是
A.WX2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类塑都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X <W<Y<Z
12、下列说法正确的是
A.乙烯的结构简式可以表示为CH2CH2
B.苯、乙醇和乙酸都能发生取代反应
C.油脂都不能使溴的四氯化碳溶液褪色
D.液化石油气和天然气的主要成分都是甲烷
13、有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
14、氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,![]() 减小 B.通入少量SO2,溶液漂白性增强
减小 B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
15、草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)== 0时,c(W)== 1 × 10-2 mol/L
B.V(NaOH)<
10 mL时,不可能存在c(Na+)==
2 c(C2O![]() )+
c(HC2O
)+
c(HC2O![]() )
)
C.V(NaOH)== 10 mL时,c(W)== 1 × 10-7mol/L
D.V(NaOH)>
10 mL时,c(Na+)>
c(C2O![]() )>c(HC2O
)>c(HC2O![]() )
)
16、有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
17、往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为
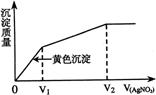
A (V2-V1)/V1 B V1/V2
C V1/(V2-V1) D V2/V1
二、填空题
18、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
(1)K=c(CH3OH)/c(CO)·c2(H2) 减小
(2)2nB/3tBmol·(L·min)-1
(3)b c
(4)Cu2O+CO![]() 2Cu+CO2
2Cu+CO2
19、下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
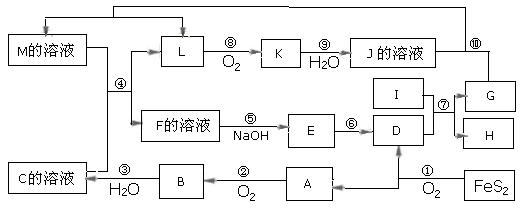
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
( 5 )将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
19.( l )四(或4 ) VIII
( 2 ) l :2
( 3 )③
( 4 ) 3Fe2+ + NO3- + 4H+ + = 3Fe3+ + NO↑+2H2O
( 5 ) Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
20.肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:
![]() +CH3CHO
+CH3CHO![]()
![]() +H2O
+H2O
(1)请推测B侧链上可能发生反应的类型:__________________________________。(任填两种)
(2)请写出两分子乙醛在上述条件下反应的化学方程式:_______________________________________________。
(3)请写出同时满足括号内条件下B的所有同分异构体的结构简式:
(①分子中不含羰基和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构。)______________________。
[答案](1)加成反应、氧化反应、还原反应、聚合反应。 (2)CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O。
CH3CH=CHCHO+H2O。
(3)![]() ,
,![]() 。
。