高三化学电化学基础单元检测题
第Ⅰ卷 选择题 (共48 分)
一、选择题(本题包括个12小题,每小题只有一个选项符合题意,每小题4分,共48分,把答案填入答案卡中)。
1、下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
2.在原电池和电解池的电极上所发生的反应,属于还原反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
3、下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
B.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁
C.钢铁表面常易锈蚀生成Fe2O3·nH2O
D.金属的腐蚀主要是电化学腐蚀
4、下列有关金属腐蚀的说法中正确的是( )
①金属的腐蚀全部是氧化还原反应 ②金属的腐蚀可分为化学腐蚀和电化腐蚀,只有电化腐蚀才是氧化还原反应,③因为二氧化碳普遍存在,所以钢铁的电化腐蚀以析氢腐蚀为主。④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化。
A.①③
B.②③ C.①④ D.①③④
5、某溶液中含有两种溶质AlCl3和H2SO4,它们的物质的量之比为2:1。用石墨做电极电解该混合溶液时,根据电极产物,可分为若干个阶段,下列叙述不正确的是( )
A.阴极自始至终只有H2 B.阳极先析出Cl2后析出O2
C.电解最后阶段为电解水 D.溶液中先有白色沉淀生成后沉淀全部溶解
6、某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是
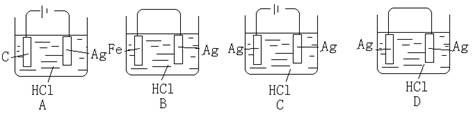 ( )
( )
7、镍的氧化物和铁作电极形成的电池叫镍铁蓄电池,又称碱性电池,其放电时总反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2。关于此蓄电池的推断正确的是( )
A.放电时负极反应式为:2Ni(OH)2-2e- Ni2O3+2H++H2O
B.放电时正极上Ni2O3发生还原反应
C.放电一段时间后,负极周围的pH一定升高
D.每消耗1mol Fe,则电路上转移的电子为1mol
8、我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4A1(OH)3,下列说法不正确的是
A.正极反应式为:O2+2H2O+4e-=4OH- ( )
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
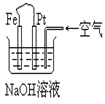 9、有关右图装置中的叙述正确的是 (
)
9、有关右图装置中的叙述正确的是 (
)
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到 Fe(OH)2 沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
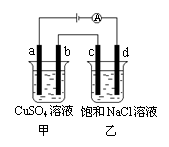 10、如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
10、如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
A.乙烧杯中d的电极反应为 2Cl––2e– =Cl2↑
B.a、c两极产生气体的物质的量相等
|
2NaCl + 2H2O ![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.甲、乙两烧杯中溶液的pH均保持不变
11、下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10摩/升,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
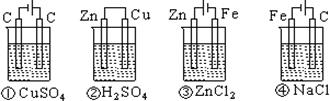
A、 工作一段时间后溶液的浓度①=②=③=④
B、 工作一段时间后溶液的pH值:④>③>①>②
C、 产生气体的总体积:④>③>①>②
D、 电极上析出的固体的质量:①>②>③>④
12、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液加入0.2mol CuO,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为( )
A.0.1mol B.0.2mol C.0.3mo1 D.0.4mol
第Ⅱ卷(非选择题 共52分)
二、填空题
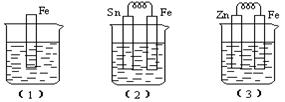
13、(7分)如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为
(2)中的电极反应:Fe:
、Sn:
Sn极附近溶液的pH(填增大、减小或不变)
(3)中被腐蚀的金属是
、其电极反应式为
。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是
。
14、(12分)如图所示,组成一个原电池.
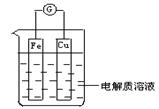
(1)当电解质溶液为稀硫酸时:
①Fe电极是__________(填“正”或“负”)极,其电极反应为________________________,
该反应是__________(填“氧化”或“还原”下同)反应;
②Cu电极是__________电极,其电极反应为______________________
该反应是__________反应.
(2)当电解质溶液为稀硝酸时:
①Fe电极是_____极,其电极反应为__________ ,该反应是_____ 反应.
分数 姓名 班级
②Cu电极是_____极,其电极反应为__________ ,该反应是_____ 反应.
15、(8分)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O 试写出:
(1)电解质溶液若为硫酸时的负极反应式
正极反应式_____________________ 。
(2)电解质溶液若为氢氧化钾溶液时的负极反应式
正极反应式_____________________ 。
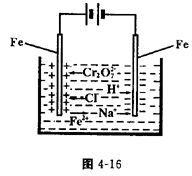 16、(12分)工业上处理含Cr2O72—的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)2沉淀产生;过滤回收沉淀,废水达到排放标准。试回答:
16、(12分)工业上处理含Cr2O72—的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)2沉淀产生;过滤回收沉淀,废水达到排放标准。试回答:
⑴ 电解时的电极反应:
阳极______________ ,阴极______________
。
⑵ Cr2O72-转变成Cr3+的离子反应方程式
⑶ 电解过程Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
⑷ 能否用Cu电极来代替Fe电极?______________(填“能”或“不能”),简述理由。
17、(2分)从NO3-、SO42-、Cl-、H+、Cu2+、Ba2+、Ag+等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是 。
18、(11分)用石墨电极电解200mL0.5mol/L的NaCl溶液,阳极收集到2.24L(标准状况)气体时,停止通电。请回答以下问题:
(1)电解过程中阳极的电极反应分别为 、 ;
(2)阴极生成的气体体积为 L(标准状况);
(3)若将阳极生成的气体通入电解后的溶液中,充分反应后,则所得溶液中离子的浓度由
大到小依次是 ;
(4)常温下,若将电解后的稀溶液稀释至1L,则溶液的pH约为 ;
(5)若将电解后阳极所产生的气体全部通入1mol/L500mLNa2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为 mol/l
选修四第四章电化学基础单元检测题
第Ⅰ卷 选择题
1C 2B 3B 4C 5D 6C 7B 8B 9C 10C 11B 12D
13、(7分,每空1分)
(1)Fe + 2H+ = Fe2+ + H2↑
(2)Fe + 2e- = Fe2+ 2H+ + 2e- = H2↑
(3) 2 1 3
14、(12分,每空1分) (1)①负Fe-2e-=Fe2+氧化
②正2H++2e-=H2↑还原
(2)①负Fe-3e-=Fe3+(或Fe-2e-=Fe2+)氧化
②正4H++NO3-+3e-=NO↑+2H2O还原
15、略(每空2,共8分)
16、(12分,每空2分)
(1)Fe-2e—=Fe2+;2H++2e—=H2↑; (2) 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++H2O;
(3)在阴极反应及Cr2O72—与Fe2+反应过程中,将大量的消耗H+使溶液pH升高,促使Fe3+、Cr3+水解并最终转化为Cr(OH)3和Fe(OH)2沉淀;
(4)不能;因阳极产生的Cu2+不能使Cr2O72—还原到低价态。
17、(2分,每个1分)BaCl2 、 HCl
18、(11分,(1)2Cl-—2e-=Cl2 ↑ 4OH-—4e-=O2 ↑+2H2O
(2)3.36
(3)c(Na+)> c(Cl-)>c(ClO-)>c(OH-)>c(H+)
(4)13 (5)0.3 (1分),其余每空2分