高三化学电解质溶液测试题
(100分钟)
一、单项选择题(本题10小题,每题3分,共分30分,每小题只有一个选项最符合题意)。
1.下列电离方程式中,错误的是
A.Al2(SO4)3=2Al3++3SO2-4 B.HF![]() H++F-
H++F-
C.HI![]() H++I- D.NaHCO3
H++I- D.NaHCO3![]() Na++HCO-3
Na++HCO-3
2.如右图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。
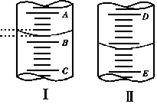 如果刻度A和D都是4,则两处液面的读数是:
如果刻度A和D都是4,则两处液面的读数是:
A.Ⅰ中是3.2 mL,Ⅱ中是3.40 mL
B.Ⅰ中是4.8 mL,Ⅱ中是3.40 mL
C.Ⅰ中是3.2 mL,Ⅱ中是4.60 mL
D.Ⅰ中是4.8 mL,Ⅱ中是4.60 mL
3.下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
4.若pH=3的酸溶液和pH=11的碱溶液等体积混合后 溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
5.下列溶液均是50ml,若分别向其中加入0.5mol/L盐酸,则溶液的导电性明显增强的是
A.0.5mol/L的H2SO4 B.0.5mol/L的NaOH
C.0.5mol/L的NH3·H2O D.0.5mol/L的AgNO3
6.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变
⑤c(H+)一定增大
A . ① B. ①⑤ C . ①②④ D . ①③
7.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为:
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
8.某黄色溶液中可能含有下列离子:K+、NH![]() 、Fe3+、Ba2+、SO
、Fe3+、Ba2+、SO![]() 、HCO
、HCO![]() 、Cl—、S2—,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
、Cl—、S2—,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
A.溶液中存在大量Fe3+ B.溶液中可能存在大量Ba2+
C.溶液中不存在大量HCO![]() 和S2— D.溶液可能呈强碱性
和S2— D.溶液可能呈强碱性
9.要求设计实验证明:某种盐的水解是吸热的。有四位同学作了如下回答其中不正确的是
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙同学:用加热方法可除去KNO3溶液中混有的Fe3+,说明含有Fe3+的盐的水解是吸热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
10.相同温度下,将足量的AgCl分别放入下列溶液中:
① 20mL0.1mol/L(NH4)2CO3溶液 ②40mL0.02mol/LBaCl2溶液
③ 40mL0.03mol/L盐酸 ④10mL蒸馏水 ⑤50mL0.05mol/LAgNO3溶液
则AgCl的溶解度大小顺序为
A.① = ② = ③ = ④ = ⑤ B. ① > ④ > ③ > ② > ⑤
C.⑤ > ④ > ① > ③ >② D. ④ > ③ > ⑤ > ① > ②
二选择题(本题包括10小题,每小题4分,共40分。每小题有一个或二个选项符合题意)
11.下列叙述正确的是
A.将pH=2的H2SO4与pH=12的 NH3·H2O溶液等体积混合后,混和液pH<7
B.将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混和液13<pH<14
C.pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7
D.某温度下水的离子积为1×10—12,若使pH=1 H2SO4与pH=12 NaOH溶液混合后溶液呈中性,则两者的体积比为1:10
12.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和Mg(OH)2
13.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
14.常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且c(OH—)>c(Na+)> c(H+)>c(CH3COO—)
B.pH>7,且c(Na+)+c(H+)=c(CH3COO—)+c(OH—)
C.PH<7,且c(CH3COO—)>c(H+)>c(Na+)>c(OH—)
D.pH=7,且c(CH3COO—)>c(Na+)>c(H+)=c(OH—)
 15.已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同,体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是:
15.已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同,体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是:
A.加水稀释,两溶液中的氢离子数目都不变
B.用等浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少
C.跟等质量铝粉反应,盐酸比甲酸的起始反应速率快
D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
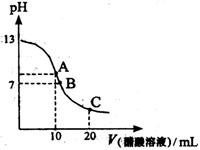
16.25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:
A.在A点:c(Na+)> c(OH—)> c(CH3COO—)> c(H+)
B.在A点:c(Na+)+ c(H+)==c(OH—)+c(CH3COO—)
C.在B点:c(CH3COO—)> c(Na+)> c(H+)= c(OH—)
D.在C点:c(CH3COO—)> c(Na+)> c(H+)> c(OH—)
17.将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c(CO32-) B.能使酸性高锰酸钾溶液褪色
C.c(Na+)等于c(CO32-)与c(HCO3-)之和 D.c(HCO3-)略小于c(CO32-)
18.常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
A.pH =12 的Ba(OH)2 B.pH =12的氨水 C.0.005mol/L NaOH D.0.05mol/LBaCl2
19.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c(HCN)<c(CN-) B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1mol·L-1
![]() 20.以水为溶剂进行中和滴定的原理是:H3O++OH—
20.以水为溶剂进行中和滴定的原理是:H3O++OH— 2H2O。已知液态SO2和纯水的导电性相近,液态SO2也能发生自电离:2SO2 SO![]() +SO2+;△H>0。下列叙述中错误的是
+SO2+;△H>0。下列叙述中错误的是
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:SO![]() +SO2+
+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO![]() )与c(SO2+)的乘积是一个常数
)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
三、填空题(本题包括5小题,共80分)
21.现有浓度为0.1
mol·L-1的五种电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,已知:CO2+3H2O+2AlO2-![]() 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是____________________(填编号,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是__________;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是____;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式______________________________________。
22.(1)有五瓶溶液分别是①10毫升0.60摩/升NaOH水溶液 ②20毫升0.50摩/升硫酸水溶液 ③30毫升0.40摩/升HCl溶液 ④40毫升0.30摩/升CH3COOH水溶液 ⑤50毫升0.20摩/升蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________。
(2)25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=__________(填数据);②若x+y=13,则a/b=_________(填数据);
③若x+y>14,则a/b=___________(填表达式);
23.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
24.已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……,今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=2B2-+2HA C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是 .
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子,最易结合质子(H+)的是 最难结合质子的是 .
(3)下列反应的离子方程式正确的是 .A.H3C+3A-=3HA+C3-阶 B.HB-+A-=HA+B2-
(4)完成下列反应的离子方程式
A.H3C+OH-(过量)= B.HA(过量)+C3-=
25.维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6 + I2 = C6H6O6 + 2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol/LCH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中。加入1mL指示剂,立即用浓度为0.05000mol/L的I2溶液进行滴定,直至滴定终点,共消耗21.00mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)所用的指示剂为______________
(3)在滴定过程中,应用左手控制滴定管的_________(填部位),右手摇动锥形瓶,眼睛注视______________,直到滴定终点。滴定至终点时的现象是________________。
(4)样品中维生素C的质量分数为_____________。
第九讲 电解质溶液测试题(100分钟)
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题(请在密封线内作答)
| 21.(14分) (1)___________ ___(填编号,下同); (2)___ _; (3)__ __; (4)______________ __ ___________。 22.(13分) (1)___________________ (2)_____ ________ ________ ___________ ___ 23.( 18分) 该反应的离子方程式为 ⑴ 。 ⑵ ⑶ 。 24. (20分) (1) . (2) . (3) . (4)完成下列反应的离子方程式 A.H3C+OH-(过量)= B.HA(过量)+C3-= 25.(15分) (1)
(2)所用的指示剂为______________ (3)在滴定过程中,应用左手控制滴定管的_________(填部位),右手摇动锥形瓶,眼睛注视______________,直到滴定终点。滴定至终点时的现象是_______ __ ___ __ __。 (4)样品中维生素C的质量分数为 . |
第九讲 电解质溶液测试题答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | B | B | C | B | C | D | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | D | AD | B | BD | A | CD | BD | C |
21.(14分)
(1)④②①③⑤ (4分) (2)⑤ (3分) (3)①② (3分)
(4)HCO3-+AlO2-+H2O![]() Al(OH)3↓+CO32- (4分)
Al(OH)3↓+CO32- (4分)
22.(13分)
(1)⑤④③②①;(3分)
(2)1:1;(3分) 1:10;(3分) 10x+y-14(4分)
23.(18分)HCO3-+H2O![]() H2CO3+OH-(3分);大于(2分);⑴乙(2分);B(2分);
H2CO3+OH-(3分);大于(2分);⑴乙(2分);B(2分);
⑵等于(2分);甲(2分);⑶乙(2分);常压下加热NaHCO3的水溶液,溶液的温度达不到150℃(3分)
24.(20分)
(1)H2B (3分) (2)C3- (3分) HB- (3分)
(3)B (3分) (4)A C3-+3H2O (4分) B 2A-+H2C-(4分)
25.(15分)
(1)煮沸是为了除去溶液中溶解的O2,避免维生素C被O2氧化,冷却是为了减缓滴定过程中维生素C与液面上空气接触时被氧化的速度。(3分)
(2)淀粉溶液(2分)
(3)活塞;(2分)
锥形瓶内溶液颜色变化,(2分)溶液无色变蓝色,且半分钟内不恢复原色。(2分)
(4) = 92.40%(4分)