高三化学第一学期12月月考试题
说明:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间
90分钟。
2.请将第Ⅰ卷选择题的正确答案填涂到答题卡上。考试结束时,只收答题卡和第Ⅱ卷。
相对原子质量:H—1 C—12 N—14 O—16 Na—23 Fe—56 Ag—108
第Ⅰ卷(选择题,共44分)
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
1.随着人们生活质量的不断提高,废电池集中处理的问题被提到议事日程,其首要原因是
( )
A.回收电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.避免电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
2.下列各种金属的治炼方法中,可制得相应金属的是 ( )
A.加热氧化铝 B.加热碳酸钙
C.电解熔融氯化钠 D.氯化钠与铝高温共热
3.下列关于铜电极的叙述正确的是 ( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
4.下列叙述正确的是 ( )
A.进行中和滴定操作时,眼睛要始终注视滴定管内液压面的变化
B.在中和滴定中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液
C.滴定时,锥形瓶未干燥,则所测浓度偏低
D.用KMnO4溶液滴定FeSO4溶液时,应选用碱式滴定管
5.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是 ( )
A.该反应一定为氧化还原反应
B.因该反应为放热反应,故一定不必加热就可以发生
C.X和Y的总能量一定高于M和N的总能量
D.该反应的△H>0
6.相同温度和等物质的量浓度的下列溶液中,pH最小的是 ( )
A.NH4Cl B.(NH4)2SO4 C.NH4HSO4 D.NH4HCO3=
7.某同学想用实验证明氯化铁溶液的黄色不是由Cl—引起的,设计的下列实验无意义的是
( )
A.观察氯化钠溶液,其呈无色
B.向氯化铁溶液中滴加适量的硝酸银溶液,震荡后静置,溶液黄色未消失
C.向氯化铁溶液中滴加适量的氢氧化钠溶液震荡后静置,溶液黄色消失
D.观察铁丝在氧气中燃烧的产物为黑色
8.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:
![]() Ca(OH)2(s)
Ca2+(aq)+2OH—(aq)。当向悬浊液中加少量生石灰后,若温度保持不变,下列判断不正确的是 ( )
Ca(OH)2(s)
Ca2+(aq)+2OH—(aq)。当向悬浊液中加少量生石灰后,若温度保持不变,下列判断不正确的是 ( )
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液pH不变 D.氢氧化钙固体的质量增加
9.在合成氨的工业生产中,既能增加NH3的日产量,又能使平衡向右移动的措施是( )
A.不断将氨分离出来 B.使用催化剂
|
10.为了除去镀在铝表面的铜镀层,可选用的试剂是 ( )
A.浓硝酸 B.稀硝酸 C.浓硫酸 D.NaOH溶液
二、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)
11.下列叙述不正确的是 ( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
B.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁
C.钢铁表面常易锈蚀生成Fe2O3·nH2O
D.金属的腐蚀主要是电化学腐蚀
12.PH相同的氨水和NaOH溶液,分别用蒸馏水稀释到原来的x倍和y倍,稀释后2种溶液的pH仍然相同,则x、y的关系为 ( )
A.x=y B.x>y C.x<y D.无法确定
13.某单质X能从Y的盐的溶液中置换出单质Y。由此可知 ( )
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y只能是金属
D.当X是非金属时,Y可能是金属,也可能是非金属
14.下列反应的离子方程式中书写正确的是 ( )
A.氢氧化钠溶液吸收过量的CO2 CO2+2OH—=CO32—+H2O
B.铝溶于盐酸中 Al+2H+=Al3++H2↑
C.等体积等物质的量浓度的氢氧化钡溶液和碳酸氢铵溶液混合
Ba2++2OH—+NH4++HCO3—=BaCO3↓+NH3·H2O+H2O
D.FeBr2溶液中通入过量氯气
2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl—
15.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟NO浓度增加 ( )
A.0.001mol·L—1 B.0.002 mol·L—1
C.0.06 mol·L—1 D.0.01 mol·L—1
16.已知BaCO3为白色沉淀,其Ksp为2.58×10—9 mol2·L—2;BaCrO4为黄色沉淀,其Ksp为1.17×10—10mol2·L—2。试管中盛有BaCO3的饱和溶液,溶液底部尚有固体BaCO3,若加入足量浓Na2CO3溶液,则下列描述正确的是 ( )
A.固体全部溶解 B.固体仍为白色
C.固体变为黄色 D.固体的物质的量不变
17.某无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在①Cu2+;②Fe3+;③Cl—;④NO3—;⑤S2—;⑥CO32—;⑦NH4+;⑧Mg2+;⑨Al3+;⑩[Al(OH)4]—。其实,上述离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是 ( )
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨ C.③④⑦⑧⑨ D.①②③⑤⑥⑩
18.向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )
A.Ba2+(aq)+SO42—(aq)=BaSO4(s);△H=-2.92kJ·mol—1
B.Ba2+(aq)+SO42—(aq)=BaSO4(s);△H=-0.72kJ·mol—1
C.Ba2+(aq)+SO42—(aq)=BaSO4(s);△H=-73kJ·mol—1
D.Ba2+(aq)+SO42—(aq)=BaSO4(s);△H=-18kJ·mol—1
|
三、(本题包括1小题,共11分)
19.(11分)现有常温下0.1 mol·L—1的纯碱溶液。
(1)下列纯碱溶液中离子浓度之间的关系正确的是 。
A.[H+]+[Na+]=[OH—]+[HCO3—]+2[CO32—]
B.[OH—]=[H+]+[HCO3—]+2[H2CO3]
C.[Na+]=2{[CO32—]+[HCO3—]+[H2CO3]}
D.[CO32—]=[HCO3—]+[H2CO3]
(2)纯碱溶液呈碱性,其原因是(用离子方程式表示)
,验证纯碱溶液呈碱性的实验方法(简述操作过程):
。
(3)纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)
(4)某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32—不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
四、(本题包括2小题,共21分)
20.(7分)利用煤炭燃烧的反应热通常有以下两种途径:
Ⅰ.煤炭在空气中直接燃烧。
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使氢气和一氧化碳在充足的空气中
燃烧。这两个过程的热化学方程式分别为:
Ⅰ.C(s)+O2(g)=CO2(g) △H1(298K)=a kJ·mol—1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) △H2(298K)=b kJ·mol—1
H2(g)+1/2O2(g)=H2O(g) △H3(298K)=c kJ·mol—1
CO(g)+1/2O2(g)=CO2(g) △H4(298K)=d kJ·mol—1
填写以下空白:
(1)等质量的煤炭分别按以上两个不同途径反应,对产生的反应热进行比较,正确的是
A.Ⅰ比Ⅱ多 B.Ⅰ比Ⅱ少 C.Ⅰ和Ⅱ在理论上相同
(2)在实际应用中,途径Ⅰ与途径Ⅱ相比,哪个途径更好 (填Ⅰ或Ⅱ),理由是 。
![]() 21.(4分)对于2SO2(g)+O2(g) 2SO3(g) △H<0反应来说:
21.(4分)对于2SO2(g)+O2(g) 2SO3(g) △H<0反应来说:
(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min建立平衡,此时测得SO3浓度为0.8mol·L—1,则
①平衡时,SO2的转化率为
②从开始至2min用氧气表示的平均速率为v(O2)=
③该条件时反应的平衡常数K= 。在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有 (填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出氧气
(2)一定温度下,若将8mol SO2气体和4mol O2气体混合置于体积可变、压强恒定的密闭容器中,经t1时间达到平衡,测得混合气体的总物质的量为10mol。
试回答下列问题:
①若在t1时充入一定量的氦气,SO3的物质的量将 (填增大、减小或不变)。
简要说明原因 。
②若在t1时保持温度和压强不变,使SO2、O2、SO3三种气体均增加1mol,则平衡(填“向左移动”、“向右移动”或“不移动”) 。
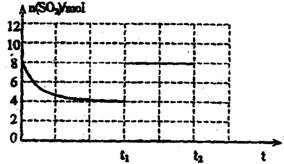
③若其它条件不变,在t1时再在容器中加入4mol SO2,2mol O2,4mol SO3气体,在下图中做出O→t1→t2点这段时间内SO2的物质的量变化曲线。
|
五、填空题(本题包括2小题,共24分)
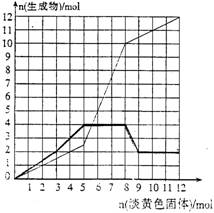
22.(9分)某溶液中可能含有Fe3+、Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加
|
请填写下列空白:
(1)所加的淡黄色固体是 (填名称),淡黄色固体与水反应的离子方程式为 。
(2)在该溶液中含有的离子是 ,它们的物质的量浓度之比为
,这些离子在上述溶液中参与反应的先后顺序为 。
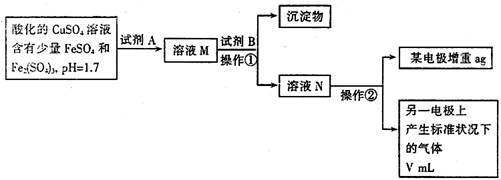
23.(15分)某学生拟用含有FeSO4和Fe2(SO4)3的CuSO4溶液提纯CuSO4,并测定铜的相
对原子质量,其实验流程如下图所示:
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 供选择的试剂有:Cl2、H2O、浓H2SO4、NaOH溶液、CuO、Cu | ||
|
试回答下列问题:
(1)试剂A的化学式为 ,加入试剂A反应的离子方程式为
|
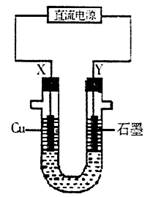
(2)操作②中所用仪器装置如右图所示:则X应接直
流电源的 极,Y电极上发生的电极反应
式为 。
(3)下列实验操作必要的是 (填字母)。
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极的烘干称重的操作中必须按:
烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)向电解后的溶液中加入石蕊溶液,观察到的现象是 。
(5)铜的相对原子质量的计算式为 。
参考答案
1.B 2.C 3.C 4.B 5.C 6.C 7.D 8.B 9.A
10.A 11.B 12.B 13.A 14.C 15.A 16.C 17.D 18.D
|
![]()
![]() (2)CO32—+H2O HCO3—+OH— HCO3—+H2O H2CO3+OH—(2分)用洁净的玻璃棒蘸取少许纯碱溶液点在pH试纸的中央,pH试纸显蓝色,说明碱溶液显碱性。(2分)(其他合理答案同样给分)
(2)CO32—+H2O HCO3—+OH— HCO3—+H2O H2CO3+OH—(2分)用洁净的玻璃棒蘸取少许纯碱溶液点在pH试纸的中央,pH试纸显蓝色,说明碱溶液显碱性。(2分)(其他合理答案同样给分)
(3)3CO32—+2A13++3H2O=2A1(OH)3↓+3CO2↓(2分)
(4)用pH试纸测常温下0.1mol·L—1纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点错误。(2分)(其他合理答案同样给分)
20.(7分)(1)C(2分)
(2)Ⅱ(2分)煤的利用率高,变成气体后燃烧充分,减少了污染,运输方便,运输成本低(只要答对三点即给3分)
21.(14分)(1)①80%(1分)②0.2mol·L-1·min-1(2分)③160L·mol—1(2分)B(2分)
(2)①减小(1分)在压强不变的情况下通入氦气,相当于减小压强,则平衡向气体体积增大的方向移动,SO3的物质的量减小(2分)②向右移动(2分)③(2分)
|
22.(9分)(1)过氧化钠(1分),2Na2O2+2H2O+4Na++4OH—+O2↑(2分)
(2)NH4+、A13+、Mg2+(2分),c(Mg2+):c(A13+):c(NH4+)=1:1:3(2分)A13+、Mg2+、NH4+(2分)
23.(15分)(1)H2O2(1分)2Fe2++2H++H2O2=2Fe2++2H2O(2分)CuO(1分);调节溶液的pH在3.2—4.7之间,使Fe3+完全转化成Fe(OH)3除去。(2分)过滤(1分)
(2)负(1分)40H—、-4e—→2H2O+O2↑(2分)
(3)A、B、D、E(2分)
(4)溶液变为红色(1分)
(5)![]() (2分)
(2分)