高三化学第一学期12月月考试题卷
化 学 试 题
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 Br—80 Ag—108
一、选择题(每小题只有一个正确答案,每题2分,共20分)
1.A、B两种元素可形成AB2共价型化合物,它们的原子序数是 ( )
A.3和9 B.6和8 C.10和14 D.17和12
2.最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是( )
A.与C60中普通碳原子的化学性质不同
B.与14N含的中子数相同
C.是C60的同素异形体
D.与12C互为同位素
3.下列说法正确的是 ( )
A.用乙醇或CCl4可提取碳水中的碳单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1:1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
4.用盐酸制取等量的Cl2,被氧化的HCl的量最少的是 ( )
A.KClO3+6HCl KCl+3Cl2↑+H2O
B.Ca(ClO)2+4HCl CaCl2+2Cl2↑+2H2O
C.MnO2+4HCl MnCl2+Cl2↑+2H2O
D.2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
5.下列说法正确的是 ( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物质酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
6.关于Na元素和F元素的叙述正确的是 ( )
A.原子序数Na>F B.原子半径Na<F
C.原子的电子层数Na<F D.原子最外层电子数Na>F
7.F2是氧化性最强的非金属单质。在加热条件下,物质的量相等的F2(g)跟烧碱完全反应,生成NaF、H2O和另一种气体,该气体是下列中的 ( )
A.H2 B.HF C.OF2 D.O2
8.下列关于元素的叙述正确的是 A.金属元素非金属元素能形成共价键化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
9.硫氰(SCN)2其化学性质与卤素单质很相似,称之为拟卤素,拟卤素离子和卤离子还原性强弱的顺序为:Cl—<Br—<SCN—<I—,下列方程式不正确的是 ( )
A.(SCN)2+2Br—=Br2+2SCN—
B.(SCN)2+H2S=H++2SCN—+S
C.(SCN)2+2I—=2SCN—+I2
D.4H++2SCN—+MnO2 Mn2++(SCN)2+2H2O
|
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
二、选择题(每上小题只有一个正确答案,每题2分,共20分。)
11.氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1mol N2有6mol电子转移
12.某元素的离子R2+有5个电子层,最外层有2个电子。当RCl2固体配成溶液时,为得到澄清溶液并防止变质,常在溶液中加入少量R单质和盐酸,下列叙述正确的是( )
A.R为ⅡA族元素 B.R的最高价氧化物的对应水化物是强碱
C.R2+的硝酸盐水溶液呈中性 D.RCl2有还原性,可进一步被氧化
13.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对;Ⅱ对;有 |
| B | Cl2和SO2混合后可用于漂白 纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对;Ⅱ错;无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的光 | Ⅰ对,Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对;Ⅱ对;有 |
14.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
15.下列离子方程式的书写正确的是 ( )
A.Cl2通入水中 Cl2+H2O=H++Cl—+ClO—
B.FeBr2溶液中通入过量Cl2 2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl—
C.Cl2通入石灰乳中 Cl2+2OH—=Cl—+ClO—+H2O
D.氯酸钾与浓盐酸反应 ClO3—+5Cl—+6H+=Cl2↑+3H2O
16.下述实验能达到预期目的是 ( )
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液 | 证明SO2具有氧化性 |
| B | 将Cl2通入NaOH溶液中 | 比较氯的氧化性和还原性的强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
17.消毒是消除水中致病细菌,目前常在水中加适量漂白粉或液氯,其原理是 ( )
A.产生盐酸调节pH B.氯分子有强氧化性
C.产生的次氯酸有强氧化性 D.产生的氯离子有还原性
18.在密度为p g/mL的盐酸中,逐滴加入AgNO3溶液,直到沉淀完全为止。测知沉淀的质量和原盐酸的质量相等,则原盐酸的物质的量浓度为(mol/L) ( )
A.2.5p B.12.7p C.6.97p D.6.35p
19.实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净的氯化钠溶液,下列操作可供选用:①逐滴加入稀盐酸,调pH值为5;②煮沸;③加蒸馏水溶解;
④加热至不再产生气体为止;⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液;⑦过滤。上述实验操作的正确顺序应是 ( )
A.①②⑤⑥⑦④③ B.③④⑥⑤⑦①②
C.④③⑥⑤⑦①② D.④③⑤⑥⑦②①
20.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是 ( )
A.上述实验证明氧化性:MnO4—>Cl2>Fe3+>I2
B.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
C.实验②证明Fe2+既有氧化性又有还原性
三、填空题(共36分)
21.(7分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又知AlCl3溶沸点较低,易升华。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式
(2)Be(OH)2与Mg(OH)2可用 试剂鉴别,其反应离子方程式为
(3)BeCl2是 化合物(填“离子”或“共价”)
(4)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是
;同时还有少量 生成。
22.(7分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是 ,Y是 ,Z是 。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是
和 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 。
 23.(10分)如图:图中每一方格表示有关的一种反应物,其中粗线表初始反应物
23.(10分)如图:图中每一方格表示有关的一种反应物,其中粗线表初始反应物
请填写下列空白
(1)物质B是 F是 J是 (填化学式)
(2)反应①的离子方程式为
H→J化学方程式为
(3)写出D的电子式 ,D的水溶液里 性,(填酸性或碱性),原因是(用化学方程式表示)
24.(12分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中
燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)
;V、W的氢化物分子结合H+能力较强的是(写化学式) ,用一个离子方程式加以证明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是(写化学式) 。
四、实验题(共14分)
25.(3分)(1)在碘水中加 CCl4后,振荡静置,观察到的实验现象是
。
(2)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
|
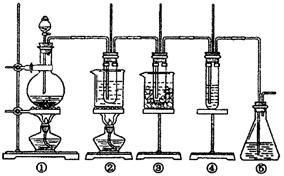
图中:①为氯气发生装置;②的试管里盛有15Ml 30% KOH溶液。并置于水浴中;③的
试管里盛有15mL 8% NaOH溶液。并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰。通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
|
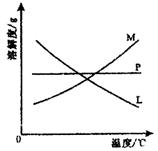
反应完毕经冷却后,
②的试管中有大量晶体析出。右图中符合该晶体
溶解度曲线的是
(填写编号字母);从②的试管中分离出该晶体的
方法是 (填写实验
操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:
(4)实验中可观察到④的试管里溶液的颜色发生如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
| 然后溶液从无色逐渐变为 色 |
|
五、计算题(共10分)
27.(4分)某元素的最高价氧化物的水化物的分子式为HxROy,气态氢化物的分子式为HxR。已知1mol HxROy比1mol HxR质量多64g,又知1mol HxROy中R的核外电子总数比1mol HxROy中氧原子的核电子总数少16mol。试求:
(1)R的原子序数;(2)用电子式表示HxR。
28.(6分)在酸性条件下,KBrO3能把KI氧化成I2或KIO3,本身被还原成为Br—或Br2。KIO3能氧化KI生成I2氧化Br—成为Br2。(自己均被还原成I2)。请写出硫酸介质中KBrO3与KI发生反应的三个化学方程式:
(1)① ,
② ,
③ 。
(2)现取1.0L 4mol/L KBrO3溶液和4.0L 10mol/L KI溶液与足量的稀H2SO4混合你认为可以发生上述三个反应的哪些反应?
(3)计算(2)中含卤素的氧化产物与还原产物的物质的量之比。
参考答案
一、
1—5 ADCBB 6—10 ACAAD
二、
11.C 12.D 13.D 14.B 15.D 16.C 17.C 18.C 19.C 20.A
|
21.(1)Be+2OH—=BeO22—+H2↑
(2)NaOH Be(OH)2+2OH— BeO22—+2H2O
(3)共价 (4)Li2O Li3N
22.(1)H N O (2)N2O5 (3)NH4+、H3O+、OH— (4)NH4NO3
![]() 23.(1)Cl2、Fe、Fe(OH)3 (2)Cl2+2OH— Cl—+ClO—+H2O
23.(1)Cl2、Fe、Fe(OH)3 (2)Cl2+2OH— Cl—+ClO—+H2O
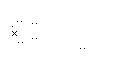 2FeCl2+5NaClO+5H2O=2Fe(OH)3↓+5NaCl+4HCl
2FeCl2+5NaClO+5H2O=2Fe(OH)3↓+5NaCl+4HCl
![]() (3)Na+[ O:Cl:]—
碱
ClO—+H2O HClO+OH—
(3)Na+[ O:Cl:]—
碱
ClO—+H2O HClO+OH—
|
(2)①3 (3)CH4 NH3 NH3+H3O+ NH4++H2O
④3Ba2++3SO2+2NO3—+2H2O=3BaSO4↓+2NO↑+4H+ SO2
四、
25.(1)分层 上层无色、下层紫红色 取水层加淀粉
26.(1)分液漏斗 B
(2)温度高 浓度大 M 过滤
(3)Cl2+2OH—=Cl—+ClO—+H2O
(4)红 Cl2与H2O反应生成HClO HClO氧化性
过量Cl2溶液于水 蓝绿
![]() 五、
五、
27.(1)16 (2)H:S:H
28.(1)BrO3—+6I—+6H+=Br—+3I2+3H2O ①
BrO3—+5Br—+6H+=3Br2+3H2O ②
6BrO3—+5I—+6H+=3Br2+5IO3—+3H2O ③ (改成化学方程式)
(2)① ③
(3)9:5