试卷类型:A
高三化学第一学期期中教学质量统一检测
高三化学试题(90分钟)
说明:1. 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。
2. 请将选择题答案涂在答题卡上。考试完毕,只交答题卡和第Ⅱ卷
可能用到的数据:相对原子质量 :H 1 C 12 O 16 S 32 Cl 35.5 K 39 Cu 64 Ca 40
第Ⅰ卷(选择题,45分)
(每小题3分,共45分,每小题只有一个选项是符合题目要求的)
1.下述做法符合“节能减排”环保要求的是
A.鼓励使用煤等燃料以替代昂贵的石油
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车以缓解城市交通压力
2.下列说法正确的是
A.![]() 和
和![]() 互为同位素,性质相似。
互为同位素,性质相似。
B.明矾和漂白粉常用于自来水的净化和杀菌消毒,但两者的作用原理不相同。
C.光导纤维非常细,导光能力非常强,能同时传输大量信息且不受电磁干扰,光导纤维是由硅晶体制成的。
D.工业制硫酸的尾气中,含有SO2 等有害气体,如果直接排入大气,可能形成光化学烟雾。
3.关于二氧化碳是否为大气污染有不同的观点。认为“二氧化碳不是大气污染物”的理由是
①二氧化碳是重要的化工原料;②二氧化碳是植物光合作用的必需原料;③二氧化碳是无色、无味、无毒的气体;④除二氧化碳外,甲烷、一氧化二氮也是温室气体
A.①② B.②③ C.③④ D.①④
4.碱金属与卤素所形成的化合物大都具有的性质是
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤ C.①④⑤ D.②③
5.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:
![]() ;
;
下列说法正确的是
A.KClO3在反应中得到电子
B.ClO2 是氧化产物
C.H2C2O4在反应中被还原
D.1 mol KClO3 参加反应有 2 mol 电子转移
6.下列实验操作正确的是
A.粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
B.容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
C.不慎将浓苛性钠溶液沾到皮肤上,立即用H2SO4 中和并洗涤
D.测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较
7.右图中a、b、c、d、e为周期表前4周期的一部分,下列叙述正确的是
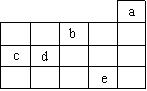 A.b元素除0价外,只有一种化合价
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素形成的单质性质最稳定
C.c、d元素最高价氧化物的水化物酸性:c > d
D.e元素在自然界中主要存在于海水中
8.第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x元素在常温下稳定存在的氧化物一定能与烧碱反应
D.x的单质一定是良好的半导体材料
9.下列实验方案中,不可行的是
A.用加入足量铜粉的方法除去Cu(NO3)2 溶液中混有的AgNO3
B.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C.加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.先后添加石蕊试液、BaCl2 溶液,将盐酸、硫酸、硫酸钠、氢氧化钠四种无色溶液鉴别开
10.以NA表示阿佛加德罗常数,下列说法不正确的是
A.1molH2中含有2mol氢原子和2mol电子
B.1molH2O的质量等于NA个H2O分子的质量总和
C.13.6 g熔融的KHSO4 中含有0.2 NA个阳离子
D.标准状况下,11.2L水中含0.5NA个氧原子
11.下列关于元素的叙述正确的是
A.金属元素与非金属元素只能形成离子化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有32种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
12.下列反应的离子方程式书写正确的是
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl- ![]() Cl2↑+ Mn2+
+ H2O
Cl2↑+ Mn2+
+ H2O
B.向氯化铝溶液中加入过量的氨水 :Al3++4NH3·H2O=AlO2—+4NH4+ +2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3 +4H+ = 2Cu2+ +CO2↑+3H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:
Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
13.下列各组离子,能大量共存且在加入铝粉后能放出氢气的是,
A.NO3- CO32- Na+ H+ B.Na+ Ba2+ Mg2+ HCO3- OH-
C.NO3- Ca2+ K+ Cl- H+ D.Na+ K+ AlO2- Cl- OH-
14.由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出。下列判断正确的是
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
15.向2mL0.5mol/L的FeCl3溶液中加入3 mL5mol/L的KF溶液,发现FeCl3溶液渐渐褪至无色,再加入KI溶液和CCl4振荡后,静置,不见CCl4层有紫红色,则下列说法正确的是
A.Fe3+不与I-发生反应 B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱 D.Fe3+被F-还原为Fe2+ ,使溶液中不再存在Fe3+
高三化学试题
第Ⅱ卷(非选择题,55分)
| 题号 | 16 | 17 | 18 | 19 | 20 | 附加题 | 总分 |
| 分数 |
16.(9分)化学与我们的生活息息相关,合理使用化学物质,提高生活质量是应引起我们关注的问题。请回答下列问题:
(1)1989年世界卫生组织把铝列为食品污染物之一,一个成年人每日摄入量应控制在4mg以下,因铝元素含量较多会引发人体患老年性痴呆 。铝在下列应用时应加以控制的是(填序号) 。
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药片 ⑦制银白色油漆 ⑧铝制易拉罐 ⑨用铝箔包装糖果和小食品。
(2)铁是人体必须的微量元素之一,当铁的摄入量不足时,可能会导致缺铁性贫血,对于缺铁人群可以服用补铁剂或补铁保健品。下列可以作为补铁剂原料的是
(填字母序号)。
A.硫酸亚铁 B.硫酸铁 C.葡萄糖酸亚铁 D.乳酸亚铁
设计实验检验某补铁保健品中是否含有铁,写出实验步骤、现象、结论和相关反应的离子方程式:
。
17.(11分)①某同学用下图所示装置制备SO2并验证其性质。
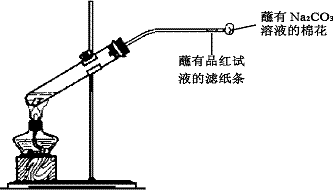
试管内有一小片铜片和浓硫酸,试管内发生反应的化学方程式为
;
导管中品红试纸的作用是 ;
导管口蘸有碳酸钠溶液的棉花的作用是 ;
相关的化学方程式
。
②实验室中现有下列实验用品:氢硫酸、NaOH溶液、KMnO4溶液、脱脂棉、镊子、pH试纸、玻璃棒
请设计实验验证SO2的还原性,简述实验操作步骤和现象
。
18.(11分)

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,元素甲的名称是 ;
(3)元素乙的原子最外层电子数是内层电子数的2倍,甲、乙的最高价氧化物对应的水化物中酸性较强的是 (填化学式),写出可以验证该结论的一个离子反应方程式 。
(4)元素丙是地壳中含量最多的金属元素,则丙原子半径与甲原子半径比较:
> (用元素符号表示),丙的氯化物水溶液与足量的NaOH溶液反应生成一种无色溶液,写出该反应的离子方程式: 。
19.(8分)A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出):


(1) 若A是常见的金属单质,D、F是短周期元素的气体单质,反应①在水溶液中进行,
则反应②(在水溶液中进行)的离子方程式是 ;
F元素的原子结构示意图为 。
(2)若A是常见的非金属固态单质,D、F是短周期元素的气体单质,反应②是气体间的反应,则反应①(在高温下进行)反应的化学方程式是 ;
F元素单质的化学式为 。
20.(8分)图中各物质均由原子序数20之前的常见元素组成。已知A、B、K为单质,且在常温下A和K为气体,B为一活泼金属。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂(其水溶液呈中性)。它们的相互转化关系如图所示(图中反应条件未列出)。请回答下列问题:

(1)I的化学式为_____________;J的化学式为__________________。
(2)反应①的化学方程式为______________________________________________。
(3)F的水溶液与氯气反应的离子方程式为___________________________________。
(4)生产11.1kg干燥剂J所消耗的H理论上能生产化肥I kg。
附加题:(8分)
有一包黑色物质为氧化铜和氧化亚铁的混合物。实验小组欲利用该黑色粉末制取较纯净的硫酸铜,通过查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+ 、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3。实验小组设计了如下实验方案:

![]()
试回答:试剂1为 ,试剂2为 (填字母),固体X的化学式是 ;
操作1的名称为 。
高三化学试题参考答案
选择题:(每个3分,共45分)
1B、2B、3B、4A、5A、6D、7D、8C、9B、10D、11C、12D、13D、14B、15B
16.(9分)
(1)③④⑤⑥⑧⑨ (3分,写对4个得1分,写对5个得2分,多选或错选不得分)
(2)ACD(3分,每个一分);
取补铁保健品配成溶液,将所得无色溶液少量于试管中,加入几滴KSCN溶液,没有明显变化,向试管中加入少量氯水,振荡,溶液变为红色,说明该保健品中含有亚铁离子。
(3分)(加入NaOH溶液检验,现象、结论正确也可得分)
17(11分)
①Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O;(2分)
CuSO4+SO2↑+ 2H2O;(2分)
验证SO2的漂白性(2分); 吸收多余的SO2防止污染大气(2分);
SO2+Na2CO3 = Na2SO3 + CO2 (2分);
②用镊子夹取脱脂棉蘸取KMnO4溶液,然后将棉团代替碳酸钠溶液的棉团,过一段时间观察棉团紫色消失或变浅,则证明SO2具有还原性(3分)。
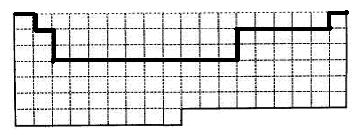 18题(11分)
18题(11分)
(1)( 2分)
(2)硫(2分)
(3)H2SO4,(1分) 2H+ +CO32- = H2O + CO2↑ ; (2分)
(4)Al>S;(2分) Al3+ + 4OH-=AlO2-+2H2O (2分)
19(8分)(每空2分)
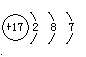 (1)2Fe2++Cl2=2Fe3++2Clˉ;
(1)2Fe2++Cl2=2Fe3++2Clˉ;
(2)C+H2O=CO+H2 ; O2
20.(8分)
(1)NH4Cl;CaCl2。 (2分)
(2)Ca3N2+6H2O = 3Ca(OH)2+2NH3↑。 (2分)
(3)2OH-+Cl2 = Cl-+ClO-+H2O。 (2分)
(4)107kg (2分)
附加题(8分)(每空2分)
B; D; Fe(OH)3; 蒸发、降温、结晶。