高三化学第一学期期中考试试题
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间100
分钟。
可能用到的相对原子质量:H—1 O—16 Na—23 Cl—35.5 Al—27 Fe—56
第Ⅰ卷(选择题,共44分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡
皮擦干净后,再选涂其他答案。
一、选择题(每小题只有一个选项符合题意,每题2分,共20分)
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是 ( )
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等
富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属
于碳氢化合物
C.用米汤检验加碘食盐中的碘酸钾(KIO3)
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
2.为迎接08北京奥运会的举行,北京大力开展“蓝天计划”行动,实施了一系列举措。其中能够直接减少SO2排放的最有效的措施是 ( )
A.建立三北防护林,减少沙尘的污染 B.提高汽车尾气的排放标准
C.减少燃煤的使用 D.使用天然气、液化石油气等清洁能源
3.下列说法或表示方法正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由C(石墨)→C(金刚石)△H=+119kJ·mol—1可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的化学
方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol—1
D.在稀溶液中,H+(aq)+OH—(aq) (H2O)(l)△H=-57.3kJ·mol—1,若将含
0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ。
4.1919年,科学家第一次实现了人类多年的幻想——人工转变元素。这个核反应如下:
![]() 下列叙述正确的是 ( )
下列叙述正确的是 ( )
A.![]() O原子核内有9个质子
O原子核内有9个质子
B.![]() H原子核内有1个中子
H原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He等稀有气体化学性质都很稳定
5.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动。制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5-36nm的磁流体。下列说法正确的是 ( )
A.所得的分散系属于溶液
B.所得的分散系中分散质为FeO
C.该分散系进行电泳实验时阳极周围黑色加深
D.油酸钠既有亲水基团又有亲油基团
6.下列叙述不正确的是 ( )
A.往下水道中倾倒硫酸溶液,会进一步加快铁制管道的腐蚀
B.在空气中,钢铁的表面涂一层油脂或油漆,可以减慢钢铁的腐蚀
C.镁与稀盐酸反应剧烈,加入醋酸钠晶体可以减慢反应速率
D.铜放入稀硫酸中,再加入硝酸钠可以加快铜与稀硫酸的反应速率
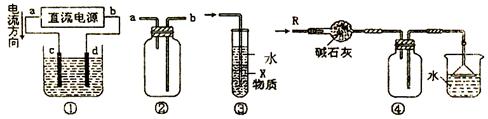
7.关于下列各装置图的叙述中,不正确的是 ( )
|
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
8.R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4—,若反应后R2O8n—离子变为
RO42—离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是( )
A.1 B.2 C.3 D.4
9.已知下述三个实验均能发生化学反应
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铜丝放入氯化铁溶液中 |
下列判断正确的是 ( )
A.实验1中铁钉只做还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
|
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅涉及氧化还原反应
二、选择题(每题有一或两个选项符合题意。每小题2分,共24分)
11.设NA为阿伏加德罗常数。下列叙述中正确的是 ( )
A.标准状况下,22.4L CO2和O2混合气体中含有的氧原子数约为NA
B.常温常压下,0.1mol铁在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2混合在V2O5存在的条件下密闭容器中加热反应后,容器内物质
分子数大于2NA
D.1L 1mol/L的K2CO3溶液中离子总数大于3NA
12.下列化学用语书写正确的是 ( )
A.少量Na2SO3溶液滴入NaClO溶液中离子方程式:
H2O+2ClO—+SO32— Cl2↑+SO42—+2OH—
B.氢氧燃料电池(KOH作电解质溶液)的正极反应式
2H2O+2e— H2↑+2OH—
C.钢铁发生吸氧腐蚀的负极反应式:Fe-3e— Fe3+
D.澄清石灰水与少量小苏打溶液混合:
Ca2++OH—+HCO3— CaCO3↓+H2O
13.X、Y为同主族元素,Y的原子半径大于X。下列说法正确的是(m、n均为正整数)( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸, 则X的氢化物溶于水一定显酸性
C.若HnY为气态,则HnX的熔、沸点一定比HnY低
D.若Y的最高正价为+7,则X的最高正价一定为+7
14.下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小
15.向含Fe3+、Fe2+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有明显变化的是 ( )
A.Fe2+ B.NH4+ C.Fe3+ D.Mg2+
16.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子。电池工作时,甲醇被氧化为二氧化碳和水,氧气的电极上的反应是:O2+4H++4e— 2H2O。下列叙述中,不正确的是 ( )
A.电池的总反应是:2CH3OH+3O2 2CO2+4H2O
B.负极的反应为:CH3OH+H2O-6e— CO2↑+6H+
C.负极的反应为;O2+4H++4e— 2H2O
D.电池工作时,H+由正极移向负极
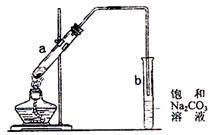
|
A.向a试管中先加入浓硫酸,然后边摇动
试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面
的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将
乙酸乙酯蒸出,使平衡向生成乙酸乙酯
的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
18.下列是除去括号内杂质的有关操作,其中正确的是 ( )
A.分离苯和己烷:蒸馏
B.NO(NO2)——通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)——让气体通过盛酸性高锰酸钾溶液的洗气瓶
D.乙醇(乙酸)——加足量NaOH溶液,蒸馏
19.常温下,0.1mol·L—1某一元酸(HA)溶液中c(OH—)/c(H+)=1×10—8,下列叙述正确的是 ( )
A.溶液中水电离出的c(H+)=10—10mol·L—1
B.溶液中c(H+)+c(A—)=0.1mol·L—1
C.与0.05mol·L—1 NaOH溶液等体积混合所得溶液中离子浓度大小关系为:
c(A—)> c(Na+)> c(OH—)> c(H+)
D.原溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH—)均增大
20.氢化铵(NH4H)与氯化铵的结构相似,又如NH4H与水反应有氢气生成,下列叙述正确的是 ( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是氧化剂
D.NH4H固体投入少量水中,有两种气体生成
![]() 21.在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-QkJ·mol—1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是 ( )
21.在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-QkJ·mol—1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是 ( )
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
A.在上述条件下反应生成1mol SO3固体放热Q/2kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
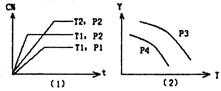
|
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示B的百分含量
C.P3>P4,Y轴表示混合气体密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
|
三、非选择题
23.(4分)下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用氨水清洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.在250ml烧杯中加入216mL水和24g NaOH固体,配制质量分数为10%NaOH溶液
F.发生急性硫化氢中毒,应迅速将患者转移到空气新鲜的地方,对患者实行人工呼吸,并迅速送医院救治。
G.用结晶法可以除去硝酸钾中混有的少量氯化钠
H.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
I.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
24.(14分)某研究性学习小组对铝热反应实验展开研究。某高中化学教材中对“铝热反应”
的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的溶点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答 (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
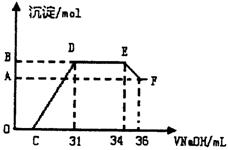
|
(1)图中OC段没有沉淀生成,此阶段发生
反应的离子方程式为 。
(2)在DE段,沉淀的物质的最没有变化,
则此阶段发生反应的离子方程式为
上述现象说明溶液中的离子结合OH—
的能力最强的是 最弱的是
(填离子符号)
(3)B与A的差值为 mol。
25.(16分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、B、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子灵敏之和与D的最外层电子数相等。
请回答下列问题:
(1)D的最高价氧化物对应水化物名称为 。
(2)C2B2的电子式为 ,其中含有的化学键类型为 。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为
。
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为 ,
若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为 ,外电路中通过的物质的量为
(5)实验室欲检验CD溶液中所含的D—,操作方法和现象为
26.(13分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略
|
试回答:
(1)若X的强氧化性单质,则A不可能是 。
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) ,检验此C溶液中金属元素价态的操作方法是 。
(3)若A、B、C为含有金属元素的有机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式可能为 ,X的化学式可能为(写出不同类物质)
或 ,反应①的离子方程式为
或 。
27.(9分)合成氨工业对化学工业和国防工业具有重要意义。
(1)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆过程
②氨水中水电离出的c(OH—) 10—7mol/L(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到依次为 。
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
(3)Ⅰ 在某压强恒定的密闭容器中加入2mol N2和4mol H2,发生如下反应:
![]() N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
达到平衡时,体积为反应前的三分之二。求:
①达到平衡时,N2的转化率为 。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:
① ②(填“>”、“<”或“=”)
Ⅱ 若将2mol N2和4mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡。
③试比较平衡时NH3的浓度:Ⅰ Ⅱ(填“>”、“<”或“=”)。
参考答案
1—5 BCDDD 6—10 DABAD
11.CD 12.D 13.A 14.B 15.D 16.CD 17.A 18.AD 19.D 20.AD 21.D 22.AD
|
24.(共14分)Ⅰ(1)合理(1分)(2)NaOH溶液(1分);
2Al+2OH—+2H2O 2AlO2—+3H2↑(2分)。(3)B(2分)
Ⅱ(1)H++OH— H2O(2分) (2)NH4++OH— NH3·H2O(2分);H+(1分);
|
25.(每空2分,共16分)(1)高氯酸 (2)
离子键和非极性共价键(或离子键和共价键)
|
(4)2Cl—+2H2O Cl2↑+H2↑+2OH—;0.71g;0.02mol
(5)取适量NaCl溶液置于试管中,向其中滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl—。
26.(13分)(1)d e(2分)
(2)FeCl3(1分);2Fe3++Fe 3Fe2+(1分),防止Fe2+被氧化(1分)
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在。(2分)(答出要点可得分,其他正确答案参照本标准给分)。
(3)Al(OH)3(1分);NaOH(或KOH)(1分);HCl(或其他强酸)(1分)
Al3++3OH— Al(OH)3↓(1分);AlO2—+H++H2O Al(OH)3↓(2分)
27.(9分)
![]()
![]() (1)①NH3+H2O NH3·H2O NH4++OH— ……1分
(1)①NH3+H2O NH3·H2O NH4++OH— ……1分
|
(2)①4NH3+3F2 NF3+3NH4F(催化剂要注明是铜) ……2分
②6 ……1分
(3)①50% …………1分
②> …………1分 ③> …………1分