高三化学上学期第一次段考试题
化学试卷
可能用到的相对原子质量:H—1 O—16 Na—23 A1—27 S—32 Cu—64
第Ⅰ卷(选择题 共48分)
一、选择题(本题每小题3分,共48分。每小题只有一个选项符合题意)
1.扫描隧道显微镜是一种新型的表面分析工具,能够操纵原子。扫描隧道显微镜,实际上就是一个由电子计算机操纵控制的长探针,它的一头变得越来越细,细到尖端就只有几个原子的厚义了。利用探针和材料平面间的电流,科学家们可以用扫描隧道显微镜调度材料平面上的原子,而且通过调节电流的大小,可逐个地把原子吸起来并放置到其他地方。下列几张图片中,可能是利用扫描隧道显微镜拍摄的图像是 ( )
|
A.采蜜的蜂鸟 B.花粉细胞 C.司母戊鼎 D.晶体硅的表面
2.2006年4月22日是第37个“世界地球日”,今年世界地球日的主题为“善待地球——珍
惜资源、持续发展”,下列不符合这一主题要求的是 ( )
A.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料
B.大力提倡使用合成洗涤剂,以减少生产肥皂对油脂的需求量
C.更新采煤、炼油技术,提高能源的利用率
D.落实资源的“3R”发展观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、
让资源循环再生(Recycle)
3.下列变化或过程属于物理变化的是 ( )
A.激光法蒸发石墨得C60 B.渗析法净化氢氧化铁胶体
C.鸡蛋白遇浓硝酸显黄色 D.直流电通过氯化钠水溶液
4.化学用语是学习化学的重要工具。下列用用来表示物质变化的化学用语中正确的是( )
A.K37C1O3与浓盐酸(HC1)在加热条件时生成氯气的化学方程式:
K37C1O3+6HC1=K37C1+3C12↑+3H2O
B.表示氢气燃烧的热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
|
Fe3++3H2O
Fe(OH)3(胶体)+3H+
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
5.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗” →变
成白色固体(粉末),下列有关叙述不正确的是 ( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸粉末
D.该过程的所有化学反应均为氧化还原反应
6.分类方法在化学学科发展中起了非常重要的作用。下列分类标准合理的是 ( )
①根据酸分子中含氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系统是否具有丁达尔效应分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①③ B.①④ C.①②④ D.②③4
7.配制1.00mol/L NaOH溶液时,由于操作不慎,使液面凹面略高下于容量瓶的刻度标线,
接下来应当采取的措施是 ( )
A.重新配制
B.倾出,蒸发水分,再重新定容
C.倾出一部分,蒸发后倾回,再重新定容
D.用胶头滴管吸去多余的溶液
8.甲物质氨水质量分数为1%的溶液与9%的溶液等体积混合,乙物质硝酸质量分数为1%的溶液与9%的溶液等体积混合,丙物质硫酸质量分数为1%的溶液与9%的溶液等质量混合,根据下表所列数据,如下叙述正确的是 ( )
A.混合后,甲、乙、丙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液溶质的质量分数小于5%,乙、丙溶液溶质的质量分数大于5%
C.混合后,甲溶液溶质的质量分数小于5%,乙的大于5%,丙的等于5%
D.混合后,甲、乙、丙溶液质量分数均等于5%
9.在做中和热的测定实验中,使用下列物品不是为了减少实验误差的是 ( )
A.碎泡沫塑料 B.环形玻璃搅拌棒
C.底部垫纸条 D.两个量筒
|
A.电解法制铝时一般是用熔融态的氧化铝进行电解但也可用其相应的盐,如熔融态的
A1C13
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的
两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
|
A.杯芳不属于烃而属于酚
B.杯底四个酚羟基相互作用,羟基间的作用力属于共价键
C.杯芳能与氢氧化钠溶液、浓溴水及酸性高锰酸钾溶液反应
|
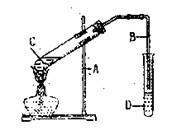
12.右图是实验室制取乙酸乙酯的装置。则下列说法正确的是 ( )
A.右边导管插入饱和碳酸钠溶液
B.反应结束后度管C液体可能会变黑色
C.试管C中加入试剂的顺序是:2mL
浓硫酸→3ml乙醇→2mL乙酸
D.试管D中油状物在下层,饱和碳酸
钠溶液主要为了中和挥发出的乙酸
13.为了区别五瓶无色溶液:HC1、A1C13、Ba(NO3)2、NaC1、Na2CO3,四位学生都没有用酒精灯,三位学生另用了试剂(甲另用了酚酞试剂 乙另用了NaOH溶液 丙另用了紫色石蕊试液),丁没有另用任何试剂,其中操作步骤一定最少的是 ( )
A.甲和丙 B.乙 C.乙和丙 D.丁
14.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向CuSO4溶液中加入一小块金属钠
B.等物质的量浓度、等体积的(NH4)2SO4与BaC12溶液
C.等物质的量NaHCO3与Na2O2固体
D.在NaBr溶液中通入少量氯气
|
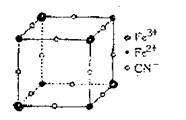
A.该晶体属于离子晶体,M呈+2价
B.该晶体属于离子晶体,M呈+1价
C.该晶体的化学式为MFe2(CN)6
D.晶体中与每个Fe3+距离最近且等距离的
CN-为3个
16.已知有机物A中含碳、氧、氮元素,且A分子为中氮原子最少,且A的相对分子质量为128,则A中氢原子数最多为 ( )
A.16 B.14 C.18 D.无法确定
|
二、(本题包括2个小题,共18分)
|
回答下列问题:
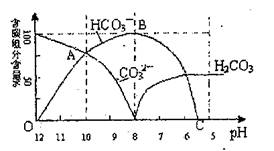
(1)在0.1mol/L Na2CO3溶液所有
阳离子和阴离子的浓度有何关
系?(用等式表示)
。
(2)当加入盐酸使溶液PH值为10
时,混合液中含碳元素的离子
物质的量之比为 。
(3)随着盐酸的加入,请写出BC段的离子方程式 。
(4)当混合液的PH= 时,开始放出CO2气体。
|
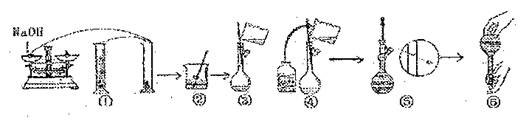
(1)在上述实验过程中,用到的容量的规格是 。
(2)用已知质量为yg的表面皿,准确称取 g NaOH固体。
(3)观察配制NaOH溶液的过程示意图,指出其中有错误的是(填操作序号)。在①—⑥中,没有体现出来的一个重要步骤是:
。
三、(本题包括3小题,共26分)
19.(8分)A、B、C、D是四种可溶于水的物质,它们分别由下列阴离子与阳离子两两组合而成,每种离子只能使用一次。
| 阳离子 | Na+ | NH4+ | A13+ | Ba2+ |
| 阴离子 | SO42- | OH- | CO32- | NO3- |
将A、B、C、D四种物质溶液两两混合(必要时,有的实验进行加热)其实验现象如下:
①将B溶液和C溶液混合产生白色沉淀,白色沉淀不溶于酸。
②将A溶液和D溶液混合产生白色沉淀,同时有气体生成。
③将A溶液和B溶液混合产生白色沉淀,同时有气体生成。
那么A、B、C、D分别为 、 、 、
。
|
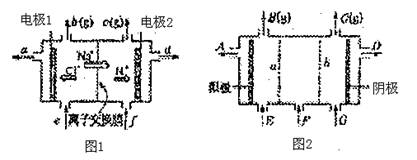
(1)电解后得到的氢氧化钠溶液从 口流出(填字母代号),b口排出的是 气体,电极1应连接电源的 极(填“正”或“负”);理论上讲,从f口加入纯水即可,但实际生产中,纯水要加入一定量的NaOH溶液,其原因是
和
。
(2)图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:a为 (填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)
。
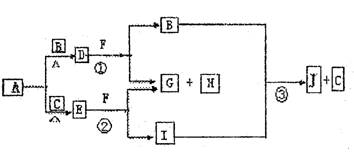
21.(8分)已知:①A、B、C为常见的单质,且单质B、C的元素同一主族,单质B、C的相对分子质量相等;
②F为正盐,B和I为气体且B无气味;
|
(1)写出D的电子式 ,E的化学式 。
(2)写出反应①的离子反应方程式 。
写出反应②的离子反应方程式 。
|
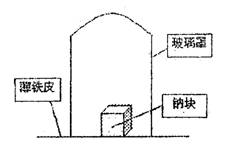
22.(8分)据材料称:钠可在氮气中燃烧生成氮
化钠,氮化钠与水反应的化学方程式是:
Na3N+4H2O=3NaOH+NH3·H2O。某学校化
学研究学习小组,为了研究钠在空气中燃烧
产物的成分,做了发以下实验:
取11.5g钠单质放在一块薄铁皮上,上扣
一玻璃罩(玻璃罩内为干燥且无酸性气体的空
气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧
产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0mL溶液,和13.5mL 1.00mol·L-1HC1溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
参考答案
第Ⅰ卷(选择题, 共48分)
|
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | B | B | C | D | B | A | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | B | B | A | B | B | A |
第Ⅱ卷(非选择题 共52分)
17.(8分)
(1)C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)(2分)
(2)n(CO32-):n(HCO3-)=1:1(2分)
(3)HCO3-+H+=CO2↑+H2O或HCO3-+H+=H2CO3(2分)
(4)6(2分)
18.(10分)
(1)500mL(2分)
(2)20.0g(2分)
(3)①③⑤(3分)将②得到的溶液冷却到室温再转移(3分)
19.(8分)A(NH4)2CO3 B.Ba(OH)2, C是Na2SO4 D是Al(NO3)3(每个2分)
20.(10分)(1)d(1分)C12(1分)正(2分),增强溶液的导电性和不影响NaOH纯度(2分)
(2)阴(2分);H2O(加少量稀H2SO4)(2分)
|
21.(8分)(1) Na+ (2分),Na2S(2分)
(2)①6Na2O2+4A13++6H2O=4A1(OH)3↓+3O2+12Na+(2分)
②3S2-+2A13++6H2O=2A1(OH)3↓+3H2S↑(2分)
22.解:n(Na)=0.500mol
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N。
n(O2)=![]() (1分)
(1分)
2Na2O2+2H2O=4NaOH+O2↑
0.0200mol 0.0100ml
n(Na2O2)=0.0200mol (1分)
Na→NaOH,由Na守恒知
c(NaOH)=0.0500mol·L-1,25mL溶液中n(NaOH)=1.25×10-2mol
n(HC1)=1.35×10-2mol>n(NaOH),说明溶液中还有氨水。(2分)
原1L溶液中n(NH3·H2O)=![]()
Na3N=4H2O=3NaOH+NH3·H2O
4.00×10-2mol 4.00×10-2mol
即:n(Na3N)=0.0400mol(2分)
n(Na2O)=(0.0500 mol-0.0400mol×3-0.0200mol×2)/2=0.170mol(2分)