高三化学上学期质量检查试题
化 学 试 题
注意事项:
1.本试题的答案要全部填写在机读答题卡相应答题栏内,答在本试题内或超出答题卡
答题栏,均不给分。考试结束,只收回答题卡。
2.选择题部分请用2B铅笔把答题卡上对应题号的答案标号涂黑。请注意:本卷中选择题分在A、B两卷中,题号连续。
3.可能用到的相对原子质量:H—I Li—7 C—12 N—14 O—16 F—19 A1—27
P—31 S—32 C1—35.5 Fe—56 Cu—64
Ag—108
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意,请将正确选项填涂到答题卡相应位置上。)
1.下列实际应用与胶体知识无关的是 ( )
A.工业生产有色玻璃 B.明矾净水
C.冶金工业用高压电除尘 D.甘油加水作护肤剂
2.据报道,2007年3月10日,在丹江口市有一辆满载10t白磷的卡车因急刹车而导致磷突
然起火,并引发周围区域火灾,事故共造成79人受伤。下列说法正确的是 ( )
A.白磷是红磷的同素异形体,它们有相同的物理性质和化学性质
B.生活污水含有磷元素,排人江河易使水体富营养化,造成藻类过分繁殖,影响水质
C.少量白磷通常保存在CS2中
D.实验室未用完的白磷应弃入废液缸中
3.常温下某溶液中由水电离产生的c(OH—)=1×10-10mol·L—1,该溶液的溶质不可能是( )
A.NaHSO4 B.A12(SO4)3 C.NaOH D.HC1
4.设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,NA个SO3分子所占的体积约为22.4L
B.7.8g Na2O2固体中所含离子的总数为0.4NA
C.1.8g重水(D2O)中所含质子的个数为NA
D.在常温常压下,46gNO2和N2O4混合物中所含原子的数为3NA
5.物质发生化学反应是:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后不发生变化的是: ( )
A.④⑤⑥ B.②⑤⑥ C.①②③⑤ D.①②⑤
6.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 ( )
| A | B | C | D | |
| 强电解质 | Fe | NaC1 | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | HC1O | Fe(OH)3 |
| 非电银质 | C12H22O11 | BaSO4 | C2H5OH | H2O |
7.石材的放射性常用镭(Ra)作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度
获得诺贝尔奖。下列叙述正确的是 ( )
A.一个![]() 原子中含有138个中子
原子中含有138个中子
B.Ra元素们于元素周期表中第六周期IIA族
C.RaC12的熔点比CaC12高
D.Ra(OH)2是一种两性氢氧化物
8.下列离子方程式书写正确的是 ( )
A.明矾溶液与小苏打溶液混合:A13++3HCO3—=A1(OH)3↓+3CO2↑
B.碳酸氢铵溶液与足量烧碱溶液混合:HCO3—+OH—=CO32+H2O
C.FeS放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑
D.铜片另入稀硝酸中:Cu+4H++NO3—=Cu2++2NO↑+2H2O
9.常温下,醋酸与氨水等体积混合后,溶液的pH=7,则下列离子浓度的比较正确的是( )
A.c(CH3COO—)>c(NH4+)>c(H+)=c(OH—)
B.c(NH4+)> c(CH3COO—)>c(H+)=c(OH—)
C.c(CH3COO—)=c(NH4+)>c(H+)=c(OH—)
D.c(CH3COO—)>c(NH4+)>c(H+)>c(OH—)
|
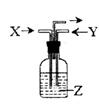
A.KC1 B.K2SO4 C.KNO3 D.K2CO3
|
| X | Y | Z | |
| A | NO2 | SO2 | BaC12 |
| B | NH3 | O2 | A12(SO4)3 |
| C | NH3 | CO2 | CaC12 |
| D | CO2 | SO2 | CaC12 |
12.下列实验方案合理的是 ( )
A.用湿润的pH试纸测定某盐溶液的pH
B.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁所附着的不溶物
C.用加热法分离I2和NH4C1的混合物
D.来了加快得到氢气,可以用纯粹代替粗锌
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
|
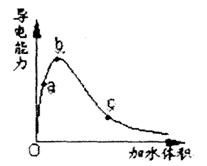
14.一定温度下,将一定质量的冰醋酸加水稀释
过程中,溶液的导电能力变化如图所示,下
列说法正确的是 ( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.若用湿润的pH试纸测量a处溶液的pH,
测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶
液中和,消耗氢氧化钠溶液体积:c<a<b
二、填空题(本题包括2小题,共24分)
15.(10分)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气法提纯,其反应式为:
(1)配平下列反应的化学方程式:
□C+□K2Cr2O7+□H2SO4 CO2↑+□Cr2(SO4)3+□K2SO4+□H2O
(2)反应的氧化剂是 ,氧化产物的最子式 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.2molCO2气体,则转移电子的物质的量是 mol。
16.(14分)下表列出了①—⑨十种元素在周期表中前四周期的位置,请回答下列问题:
|
周期序数 | IA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O |
| 二 | ⑤ | ⑥ | ⑧ | |||||
| 三 | ① | ③ | ④ | ⑦ | ⑩ | |||
| 四 | ② | ⑨ |
(1)在这十种元素形成的单质中化学性质最不活泼的是 ;(请具体元素的符号或化学式,下同)金属性最强的是 ;非金属性最强的是 。
(2)①、③两元素的氧化物对应的水化物中碱性强的是 ;(请具体物质的化学式,下同)⑤、⑦两元素的最高价氧化物对应的水化物中酸性强的是 。
(3)①、②、③三元素按原子半径由小到大的顺序排列为 。
(4)用电子式表示②、⑨两元素形成化合物的过程 。
(5)①的氧化物对应的水化物与⑦的氢化物反应的离子方程式,因物质的量配比不同产物有所不同,试分别写出有关反应的离子方程式 。
三、实验题(本题包括1小题,共16分)
|
其进行改进是研究性学习的一个重要课题。
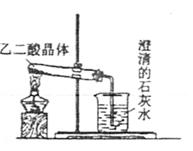
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温
度为175℃),产生CO和CO2。右图为高三教材82
页关于草酸晶体受热分解及验证部分分解产物的实验
装置图。
(1)写出草酸晶体受热分解的化学方程式:
。
(2)该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g·cm-3 | |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有同学认为,用该装置进行实验,存在不合理因素,请分析指出(任答两点):
① 。
② 。
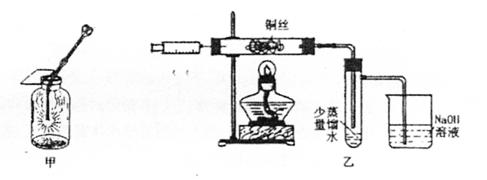
Ⅱ.下图甲是高一课本65页“铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
|
②取下注射器并集满C12;
③点燃酒精灯加热1—2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将C12缓缓推入玻璃管中;
④拔出针头,再用同样的方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入C12时,观察到铜丝继续保持红热状,由此可判断,该反应为 反应(填“放热”或“吸热”)
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动针栓,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离子方程式为 。
(3)改进后的实验与课本实验相比较,其优点为 。
四、计算题(本题包括1小题,共8分)
18.(8分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
![]() N2(g)+3H2(g) 2NH3(g)
N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,则a= 。
(2)反应达到平衡时,混合气体的体积为 716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量是 mol。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)为n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= 。
参考答案
一、选择题(42分,每题3分)
1.D 2.B 3.B 4.D 5.D 6.C 7.A 8.A 9.C
|
二、填空题(本题包括2小题,共24分)
23.(10分)
(1)3、2、8、3、2、2、8H2O(2分)
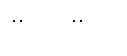 |
|
|
(3)A(2分)
(4)0.8mol(2分)
24.(14分)
(1)Ar,K,F2(各1分,共2分)
(2)NaOH,H2SO4 (各1分,共2分)
(3)K、Na、Mg(2分)
| |||
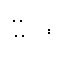 | |||
|
(5)OH—+H2S→H2O+HS—,OH—+HS—→H2O+S2—;(各2分,共4分)
(或)2OH—+H2S→2H2O+S2—
三、实验题(本题包括1小题,共16分)
21.(16分)
Ⅰ.(1)H2C2O4·2H2O
3H2O+CO↑+CO2↑(3分)
(2)CO2(1分)
(3)①草酸晶体在未达分解温度之前已熔化成液体而流出,使实验难以进行。(2分)
②CO会污染空气,而该装置未考虑尾气处理。(2分)(其它合理答案也得分)
Ⅱ.产生棕黄色的烟;(1分)
(1)放热(1分);
(2)蓝(1分);Cu2++2OH— Cu(OH)2↓(3分)
(3)防止了氯气、氯气铜颗粒逸散到空气中所带来的污染(2分)
四、计算题(本题包括1小题,共8分)
22.(8分)
(1)解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为
1:2,设反应掉的N2的物质的量为x mol。
则:x:6=1:2 解之x=3
a=13+3=16
解法二:
![]() N2+3H2 2NH3
N2+3H2 2NH3
开始时: a b 0
t时: 13 6
在t时生成6molNH3,消耗了3molN2,所以a=13+3=16
(2)n平(NH3)=716.8L/22.4L·mol-1×25%=32mol×25%=8mol
(3)5:4
(4)2:3
(5)1:2
(6)3:3:2
(评分标准:(1)和(2)各2分,其各1分)