高三化学上学期阶段性检测试卷
本试卷分为第Ⅰ卷选择题和第Ⅱ卷(非选择题)两部分,共120分。考试时间100分钟
相对原子量:H-1 C-12 N-14 O-16 Al-27 S-32 Zn-65 Fe-56 Cu-64 Mg-24
第I卷 选择题(共48分)
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有1个选项符合题意)
1.据有关媒体报导,最近意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了一种新型氧分子,并用质谱仪探测到了它的存在。这种新型氧分子是由4个氧原子构成的。下列有关这种新型氧分子的叙述正确的是
A.与![]() O互为同位素 B.等质量时所含的O原子数比O3的多
O互为同位素 B.等质量时所含的O原子数比O3的多
C.是除O2、O3外的又一种氧的同素异形体 D.与同质量的O2具有相同的体积(同温同压)
2.微观粒子是化学研究的主要对象。若阿伏加德罗常数为6.02×1023mol—1,下列对粒子数判断正确的是
A.常温常压下,2.24L CO2气体中含有的分子数为0.1×6.02×1023
![]()
![]() B.2.8g
[CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023
B.2.8g
[CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023
C.0.3L 1mol/L Na2SO4 溶液中含有的Na+数为0.3×6.02×1023
D.1.7gNH3中含有的质子数为0.4×6.02×1023
3.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.硝酸铜 C.稀盐酸 D.氢氧化钠
4.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
5.在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是
A.K+、Al3+、HCO3-、SO42- B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO- D.Na+、Ba2+、I-、SO32-
6.分别向下列溶液中加入适量的浓溴水,不会出现沉淀的是
A.NaHS溶液 B.苯酚溶液
C.溶有SO2的BaCl2溶液 D.Na2SO3溶液
二、选择题(本题包括10小题,每小题3分,共30分。每小题有1—2个选项符合题意)
7.从矿物学资料查得,一定条件下自然界存在如下反应:
![]() ,下列说法正确的是
,下列说法正确的是
A. Cu2S既是氧化产物又是还原产物 B. 5mol FeS2发生反应,有10mol电子转移
C. 产物中的![]() 离子有一部分是氧化产物
D. FeS2只作还原剂
离子有一部分是氧化产物
D. FeS2只作还原剂
8.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热放出的气体可以使湿润的红色石蕊试纸变蓝
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在原溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
9.(CN)2、(SCN)2等的性质与卤素单质相似,在化学上称为“类卤素”;CN-、SCN-等的性质也与卤离子相似,称为“类卤离子”;不同卤原子能组成卤素互化物,如溴化碘IBr,下面关于(CN)2的性质中,不像卤素的是
A.在碱溶液中生成CN-和OCN- B.跟卤素反应生成CNCl、CNBr等
C.能在空气中燃烧 D.可与银反应生成可溶盐
10.下列操作可得到纯净Al2O3的是
A.向NaAlO2溶液中加入适量稀H2SO4蒸干并灼烧
B.向NaAlO2溶液中通入过量CO2后蒸干并灼烧
C.向AlCl3溶液中加入过量氨水后蒸干并灼烧
D.向AlCl3溶液中加入适量NaAlO2溶液, 蒸干并灼烧
11.某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A.0.4mol·L-1 B.0.6mol·L-1 C.0.8mol·L-1 D.1.0mol·L-1
12.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶9 B.1∶5 C.1∶7 D.2∶9
13.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是
A.Fe3+、CI-、Na+、SO42- B.AI3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3- D.AIO2-、CO32-、K+、Na+
14.强热硫酸亚铁固体发生分解反应生成氧化铁、二氧化硫气体、三氧化硫气体,若将产生的气体通入到氯化钡溶液中,则
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
15.向1.00 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中
A.溶质为Na2CO3 B.溶质为Na2CO3、NaHCO3
C.![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H +)
16.相同状况下,在体积相同的三个烧瓶中分别盛NH3、HCl和NO2气体,并分别倒立于水槽,充分溶解后烧瓶内三种溶液物质的量浓度之比为(设烧瓶内液体未扩散到水槽中)
A.1:1:1 B.2:2:3 C.3:3:2 D.2:2:1
第Ⅱ卷 非选择题( 共72分 )
三、(本题包括3小题,共30分)
17.(10分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),拟用如下实验方案:
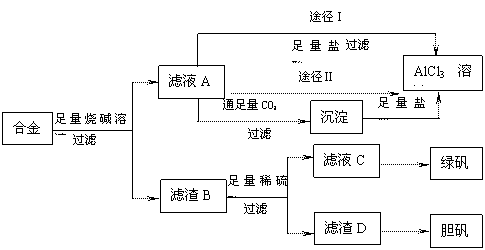

试回答下列问题:
(1)实验中多次进行过滤操作,过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是 ___________。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 __________________ 。
(4)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
18.(12分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是___________________。
 (2)氢硒酸放在空气中长期保存易变质,其可能发生的化学方程式为______________________________。
(2)氢硒酸放在空气中长期保存易变质,其可能发生的化学方程式为______________________________。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:____A12Te3+____( )一___A1(OH)3↓+_____H2Te↑
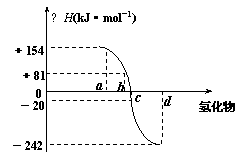
(4)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
①写出氧族元素中含有18e-的两种氢化物的电子式 。
②请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
③写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
19.(8分) 在硝酸生产过程中所排放出来的废气中含有NO和NO2,它们污染环境,现用氨催化还原法将它们转化为无毒气体(填名称) 直接排入空气中。写出有关反应方程式: , 。
假设NO和NO2物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐。写出由烧碱溶液吸收这种混合物的化学方程式: 。
四、(本题包括2小题,共20分)
20.(6分) O
‖
抗击“非典”期间,过氧乙酸(CH3C—O—OH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
![]() ① □MnO4—+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4—+□H2O2+□H+
□Mn2++□O2十□H2O
![]() ② H2O2+2
② H2O2+2![]() +2H+
I2+2H2O
+2H+
I2+2H2O
O
‖
![]() ③ CH3C—O—OH+2
③ CH3C—O—OH+2![]() +2H+ CH3COOH+I2+H2O
+2H+ CH3COOH+I2+H2O
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
![]() □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·![]() 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·![]() 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
21.(14分) 下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明)
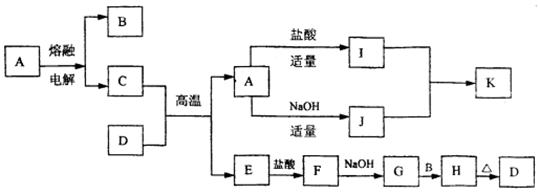
根据图示转化关系填写下列空白:
(1) 写出下列物质的化学式A ,B ,G 。
(2) C与D的混合物通常称 (填名称)。
(3) 写出下列化学方程式或离子方程式
I+J ® K (离子方程式)。
G+B ® H (化学方程式)。
(4) I的溶液通常显酸性,请用离子方程式解释原因 。
五、(本题包括2小题,共22分)
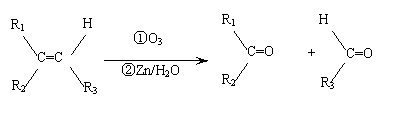 22.(10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
22.(10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
已知:
①化合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或NaOH溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与NaOH溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,完成下列填空:
(1)写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中一组):
A ,C ,E 。
(2)写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式 。
23.(12分)将97.5g锌投入100mL 18.5mol·L-1浓硫酸中充分反应,锌完全溶解,生成的混合气体中SO2和H2的体积比为1∶4。(已知:Zn+2H2SO4(浓)=ZnSO4+SO2+2H2O)求:
(1)生成的混合气体在标准状况下的体积?
(2)室温下,若将反应后的溶液加水稀释至1L,所得溶液的pH为多少?
高三化学阶段性检测试卷
班级 姓名
一、二选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三.(共30分)
17.(10分) (1)过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是
(3)该反应的总化学方程式为 。
(4)你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是
。
18.(12分)(1)硒的熔点范围可能是___________________。
(2)其可能发生的化学方程式为________________ ______________。
(3)完成下列化学方程式:____A12Te3+____( )一___A1(OH)3↓+_____H2Te↑
(4)①写出氧族元素中含有18e-的两种氢化物的电子式 。
②请归纳非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
③写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
19.(8分) (填名称)
写出有关反应方程式: ,
。
由烧碱溶液吸收这种混合物的化学方程式: 。
四.(共20分)
20.(l)配平反应①的离子方程式(配平系数填人以下方框内):
![]() □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)c0= ________________________。
21.(14分) (1) 写出下列物质的化学式A ,B ,G 。
(2) C与D的混合物通常称 (填名称)。
(3) 写出下列化学方程式或离子方程式
I+J ® K (离子方程式)。
G+B ® H (化学方程式)。
(4) I的溶液通常显酸性,请用离子方程式解释原因 。
五.(共22分)
22.(10分)(1)写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中一组):
A ,C ,E 。
(2)写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式 。
23.(12分) (1)生成的混合气体在标准状况下的体积?
(2)室温下,若将反应后的溶液加水稀释至1L,所得溶液的pH为多少?
答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | B | C | C | D | C | B |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| CD | C | C | C | B | BD | BD | A |
17.(1)烧杯、漏斗、玻璃棒 (2)蒸发浓缩、冷却结晶
(3)Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O
(4)途径Ⅱ 因为滤液A是NaAlO2和NaOH溶液,按途径Ⅰ直接向A中加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ通入CO2气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液
18.(1)113,450
(2)2H2Te+O2=2Te+2H2O
(3)1A12Se3+6 H2O→2A1(OH)3↓+3H2Se↑
(4)①![]()
![]()
②非金属元素氢化物越稳定,△H越小,反之亦然
③H2Se(g)=Se(s)+H2(g);△H=-81kJ•mol-1(每空2分,共6分)
19. 氮气 6NO + 4NH3 = 5N2 + 6H2O 6NO2 + 8NH3 = 7N2 + 12H2O NO2 + NO + 2NaOH = 2NaNO2 + H2O
20. (1)2,5,6,2,5,8
(2)淀粉溶液
(3)c0=(0.5a2b2-2.5a1b1)/b0 mol/L
21. (1) Al2O3;Fe2O3;Fe(OH)2 (2) 铝热剂 (3) Al3++3![]() +6H2O=4Al(OH)3;
+6H2O=4Al(OH)3;
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4) Fe3++3H2O==Fe(OH)3+3H+
22.
23(1)33.6L (2)1