高三化学上学期阶段性考试试卷
命题人:李新朵
可能用到的相对原子质量:C 12 N 14 O 16 Na 23 Al 27 S 32 Zn 65 Cu 64
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间90分钟。
2.答卷前考生务必将自己的班级、姓名、学号和考试科目用钢笔分别填在第II卷密封线内。
3.第Ⅰ卷答案务必答在第Ⅱ卷的答题栏中,否则不得分;第II卷用钢笔或圆珠笔直接答在试题卷上。
4.考试结束,将第II卷上交(第I卷自己保留好,以备评讲)。
第Ⅰ卷 (选择题 共48分)
一、选择题(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
6.下列4组连线中,完全正确的一组是( )
A. B.
B.
C. D.
D.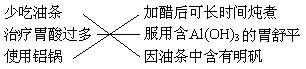
7. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
8. 如下图:A处通人氯气。关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处红色布条褪色。 由此作出的判断不正确的是( )
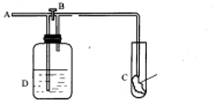 A.D中可以是浓硫酸
A.D中可以是浓硫酸
B.通入的氯气含有水分
C.D中可以是水
![]() D.D中可以是饱和氢氧化钠溶液
D.D中可以是饱和氢氧化钠溶液
9.2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1 L海水中提取出来的氘(![]() )受控核聚变成氦(
)受控核聚变成氦(![]() )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是( )
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是( )
A.氘(![]() )受控核聚变成氦(
)受控核聚变成氦(![]() )是一种化学变化
)是一种化学变化
B.![]() 和
和![]() 互为同位素
互为同位素
C.符号![]() 中的“2”与符号
中的“2”与符号![]() 中的“2”意义不同
中的“2”意义不同
D.![]() 2和
2和![]() 2的物理性质、化学性质都存在着很大的差异
2的物理性质、化学性质都存在着很大的差异
10.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是( )
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者是同分异构体
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为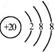 ,NH4Cl的电子式为
,NH4Cl的电子式为![]()
11.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
12.下列因果关系成立的是( )
A.因为金刚石中C-C键能>晶体硅中Si-Si键能,所以金刚石的熔沸点比晶体硅高
B.因为M(I2)>M(Br2),所以分子间作用力I2>Br2,I2的化学性质比Br2稳定
C.因为NaCl晶体中存在大量的阴、阳离子,所以NaCl晶体的导电性比Na强
D.因为冰是固体,水是液体,所以冰的密度比水大
13.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子从内到外各电子层的电子数之比为1:4:1。则下列叙述正确的是( )
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A、C原子和B、D原子分别构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)

高三化学
说明:1.答题前请将密封线内各项内容填写清楚。
2.考试结束后,只把第Ⅱ卷交回(第I卷自己保留好,以备评讲)。
选择题答题表:
一、选择题(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
第Ⅱ卷(非选择题 共60分)
二、(本题包括包括4小题,共60分)
26.(15分)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
⑴a粒子的原子结构示意图 。
⑵b与e相应元素的最高价氧化物对应水化物的碱性比较为: > (用化学式表示)。
⑶d粒子所构成的物质具有易液化的特性,推测其原因为:
。
⑷g粒子所构成的晶体类型属于 晶体。c粒子是 ,f粒子是 (用化学式表示)。
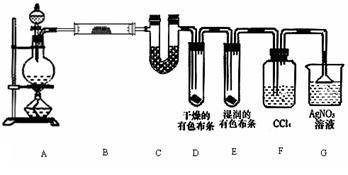 27.(15分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
27.(15分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2 ,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是
。
(2)①装置B中盛放的试剂名称为 ,作用是 ,现象是 。
②装置C和D中出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)。
28.(15分)X、Y、Z、W四种元素都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等;X的原子半径是自然界元素中原子半径最小的;W原子和Y原子最外层电子数之和为Z原子最 外层电子数的2倍,W原子最外层电子数为其电子层数的3倍。
(1)推断这四种元素的名称,它们分别是:X: ,Y: ,Z: ,W: 。
(2)写出有上述四种元素组成的既能与盐酸反应,又能与NaOH溶液反应的常见物质的化学式(各写一种)。无机物是 ,有机物是 。
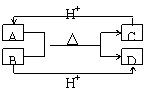 (3)A、B、C、D分别由X、Z、W中的两种原子组成为常见的含有相同电子数的分子和离子,其中A是由5个原子组成,它们之间有如下图所示的反应关系:
(3)A、B、C、D分别由X、Z、W中的两种原子组成为常见的含有相同电子数的分子和离子,其中A是由5个原子组成,它们之间有如下图所示的反应关系:
①A、B的电子式分别为:A ,B 。
②B、C、D三种粒子结合质子的能力 > > (用粒子符号表示),其理由是 。
29.(15分)有A、B、C、D四种短周期元素,A、B、C为同一周期相邻三种元素。A和C的原子序数之比为3:4,A、B、C分别与D形成的化合物的电子总数相等。试回答:
(1)由四种元素中的两种元素组成的X、Y、Z三种多原子分子,已知X分子的空间构型为三角锥形,Y、Z分子空间构型为直线形,则X属于 分子(填“极性”或“非极性”),Y、Z的结构式分别为 、 。
(2)写出实验室制取X的化学方程式 。
(3)由四种元素中的三种元素组成的化合物属于盐类,且其水溶液显酸性,则其化学式为 ,其水溶液呈酸性的原因是 (用离子方程式表示)
(4)有人建议将元素D排在周期表的ⅦA族。下列事实能支持这一观点的是 (填字母)。①H原子得到一个电子就达到稳定结构;②氢分子的结构式为H—H;③与碱金属元素形成离子化合物![]() ;④分子中原子间的化学键都属于非极性键。
;④分子中原子间的化学键都属于非极性键。
A.只有①②③ B.只有①③④ C.只有②③④ D.只有①②③④
(5)常温常压下,已知9![]() A的单质在氧气中完全燃烧生成稳定的氧化物时放出的热量为295KJ。则其燃烧的热化学方程式为
。
A的单质在氧气中完全燃烧生成稳定的氧化物时放出的热量为295KJ。则其燃烧的热化学方程式为
。
高三化学上学期阶段性考试试卷
高三化学参考答案及评分建议
一、选择题(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | A | B | C | C | C | A | A | A |
二、(本题包括包括4小题,共60分)
26.(共15分)(1) 。(2分)(2)NaOH > Mg(OH)2。(4分)
(3)NH3分子间能形成氢键,使NH3的沸点较高。(3分)
(4)分子, OH—, H3O+ (每空2分,共6分)
27.(共15分)(1)浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失(2分)
(2)① 无水硫酸铜 证明有水蒸气产生 白色变蓝色(其它合理答案也给分)(3分)②氯气无漂白性,次氯酸有漂白性 (2分)③吸收氯气(2分) ④Ag-+Cl-=AgCl↓(2分)
(3)E F (2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
28.(共15分)(1)X:氢 Y:碳 Z:氮 W:氧(每空1分,共4分)
![]()
![]()
![]()
![]()
![]() (2)(NH4)2CO3,
CH3COONH4 (每空1分,共2分)
(2)(NH4)2CO3,
CH3COONH4 (每空1分,共2分)
(3) A: [HNH]+ ,B:[OH]- (每空1分,共2分)
OH->NH3>H2O (3分) OH-+NH4+===NH3+H2O(2分) NH3+H3O+===NH4++H2O(2分)
29.(共15分)(1)极性(2分),![]() (2分),
(2分),![]() (2分)。(两者可以互换)(2)
(2分)。(两者可以互换)(2)![]() (2分)
(2分)
(3)NH4NO3(1分 )![]() (2分)
(2分)
(4)A(2分)(5)![]() ;
;![]() 。(2分)
。(2分)