高三化学九月份月考试题
化 学 试 题
第I卷(选择题,共50分)
一、选择题(每题只有一个选项符合要求,1—10题每题2分,11—20每题3分,共50分)
1、下列关于研究物质性质的基本程序:①观察物质的外观性质②实验和观察③解释及结论④预测物质的性质。排列顺序正确的是( )
A、②①③④ B、①②③④ C、①④②③ D、④①②③
2、下列物质中,前者属于纯净物,后者属于混合物的是( )
A、净化后的空气;氧化镁
B、水和冰的混合物;澄清石灰水
C、生锈的铁钉;高锰酸钾充分加热后的剩余固体
D、氯化钾;液氧
3、常用氯气给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
A、石蕊 B、硝酸银 C、亚硫酸钠 D、氯化铝
4、油炸食品如薯片、虾条等容易挤碎,不宜选用真空袋装,而应采用充气袋装。下列气体中最不应该充入的是( )
A、氮气 B、二氧化碳 C、氧气 D、氩气
5、某液体分散系所表现出来的下列性质既可能是胶体所具有,也可能是溶液所具有的是( )
A、光线透过时,从侧面可观察到一条光亮的通路
B、加入适量稀H2SO4,产生沉淀
C、分散质微粒直径小于1nm
D、装入半透膜袋中并将其浸入盛水的烧杯中一段时间,结果袋外部有分散质微粒
6、下列说法中,正确的是( )
A、常温常压下,1mol氖气含有的核外电子数为20NA
B、32g氧气和32g臭氧所含氧原子数都为2NA
C、18g水中所含的电子数是8NA
D、标准状况下,1L戊烷完全燃烧后生成二氧化碳的分子数是5NA/22.4
7、下列反应既是离子反应又是氧化还原反应的是( )
A、大理石与稀盐酸
B、硝酸银溶液与氯化钠溶液
C、锌粒与稀硫酸
D、碳跟水蒸气反应
8、下列反应中盐酸既表现酸性,又表现还原性的是( )
![]() A、MnO2+4HCl MnCl2+Cl2↑+2H2O
A、MnO2+4HCl MnCl2+Cl2↑+2H2O
![]() B、CaCO3+2HCl CaCl2+CO2↑+H2O
B、CaCO3+2HCl CaCl2+CO2↑+H2O
![]() C、AgNO3+HCl AgCl↓+HNO3
C、AgNO3+HCl AgCl↓+HNO3
![]() D、Zn+2HCl ZnCl2+H2↑
D、Zn+2HCl ZnCl2+H2↑
9、下列关于H2O的说法不正确的是( )
A、既是氢化物,又是氧化物
B、既能与酸性氧化物反应,又能与碱性氧化物反应
C、电解水可以产生H2和O2,说明水中含有两种物质
D、水分解成H2和O2时消耗能量,则H2和O2化合成水时释放能量
10、向0.1mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )
A、Na+、CO![]() B、Na+、HCO
B、Na+、HCO![]()
C、HCO![]() 、CO
、CO![]() D、Na+、OH
D、Na+、OH![]()
11、下列反应的离子方程式书写正确的是( )
![]() A、硫酸铝溶液中加入过量氨水:Al3++3OH
A、硫酸铝溶液中加入过量氨水:Al3++3OH![]() Al(OH)3↓
Al(OH)3↓
![]() B、电解饱和食盐水:2Cl
B、电解饱和食盐水:2Cl![]() +2H2O H2↑+Cl2↑+2OH
+2H2O H2↑+Cl2↑+2OH![]()
![]() C、碳酸钙与醋酸反应:CaCO3+2H
C、碳酸钙与醋酸反应:CaCO3+2H![]() Ca
Ca![]() +CO2↑+H2O
+CO2↑+H2O
D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
![]() Fe
Fe![]() +2H
+2H![]() +H2O2 Fe
+H2O2 Fe![]() +2H2O
+2H2O
12、下列式子中不正确的是( )

A、H2+CuO Cu+H2O
 |
B、Cl2+2NaOH NaCl+NaClO+H2O
 |
C、Zn+H2SO4 ZnSO4+H2↑

D、2KClO3 2KCl+3O2↑
13、某元素在化学反应中,由化合态变成游离态,则下列说法正确的是( )
①该元素一定被氧化②该元素一定被还原③该元素可能被氧化,也可能被还原④元素化合价降为![]() ⑤生成的单质为氧化产物⑥生成的单质为还原产物⑦生成的单质既可能为氧化产物也可能为还原产物⑧该过程不一定非得加氧化剂或还原剂才能实现⑨该反应不一定是放热反应⑩该反应一定不是复分解反应
⑤生成的单质为氧化产物⑥生成的单质为还原产物⑦生成的单质既可能为氧化产物也可能为还原产物⑧该过程不一定非得加氧化剂或还原剂才能实现⑨该反应不一定是放热反应⑩该反应一定不是复分解反应
A、③⑦⑧⑨⑩ B、①⑤⑩
C、②④⑥⑩ D、①②④⑤⑥
14、在下图所表示的粒子中,氧化性最强的是( )
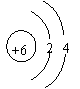 | 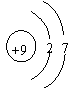 |
A、 B、
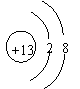 | |||
 | |||
C、 D、
15、下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是( )
A、氯化镁、氢氧化钠 B、硫酸钠、氢氧化钡
C、氯化铝、氨水 D、溴化亚铁、氯水
16、为了证明长期暴露在空气中的氢氧化钠溶液已部分变质,某同学先取2mL试样于试管中,而后进行如下实验,其中不能达到目的的是( )
A、加入适量盐酸,观察现象 B、加入澄清石灰水,观察现象
C、加入氯化钡溶液,观察现象 D、通适量CO2气体,观察现象
17、将1.15gNa投入水中,若使每100个水分子中有一个Na![]() ,则需水的质量为( )
,则需水的质量为( )
A、90g B、90.9g C、99g D、9g
18、在体积为VL的密闭容器中,通入amolCO和bmolO2,点燃充分反应后容器内碳原子数和氧原子数之比为( )
A、a:b B、a:2b
C、a:(a+2b) D、a:2(a+b)
19、将5mol·L![]() 的盐酸10mL稀释到200mL,从中取出5mL,这5mL盐酸的物质的量浓度为( )
的盐酸10mL稀释到200mL,从中取出5mL,这5mL盐酸的物质的量浓度为( )
A、0.5mol·L![]() B、0.25 mol·L
B、0.25 mol·L![]()
C、0.1 mol·L![]() D、1 mol·L
D、1 mol·L![]()
20、将一定量Na2O、Na2O2、Al组成的混合物投入足量水中,再滴加2 mol·L![]() H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为( )
H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为( )
A、无法确定 B、0.2mol C、0.4mol D、0.5mol
第II卷(非选择题,共50分)
二、填空题(本题包括3小题,共23分)
![]() 21、(5分)根据反应:8NH3+3Cl2 6NH4Cl+N2,回答下列问题:
21、(5分)根据反应:8NH3+3Cl2 6NH4Cl+N2,回答下列问题:
(1)氧化剂是_______,还原剂是______,氧化剂与还原剂的物质的量比是____________;
(2)当有68gNH3参加反应时,被氧化物质的质量是____________g,生成的还原产物的物质的量是____________mol。
![]() 22、(8分)已知Ag(NH3)
22、(8分)已知Ag(NH3)![]() +2H
+2H![]() Ag
Ag![]() +2HN
+2HN![]() 。今有一白色固体,可能由K2SO4、Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH中的2种或3种组成。为确定该白色固体组成,进行了以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色透明溶液;取少许无色透明溶液,滴加适量稀硝酸,有白色沉淀生成。
。今有一白色固体,可能由K2SO4、Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH中的2种或3种组成。为确定该白色固体组成,进行了以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色透明溶液;取少许无色透明溶液,滴加适量稀硝酸,有白色沉淀生成。
(1)按此白色固体肯定含有的物质来分析,有两种可能:
①若肯定含有的物质为2种,它们是____________________、_________________;
②若肯定含有的物质为3种,它们是_____________、_______________、___________;
(2)若要确定白色固体的组成是①还是②,仍需进行的实验是:________________
______________________________________________________。
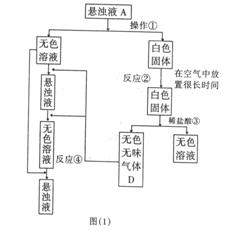
23、(10分)从某微溶物质A的悬浊液开始,可发生如图(1)所示的一系列变化。回答下面问题:
(1)A的化学式是______________;
(2)在实验室中收集气体D的方法是________________;
(3)操作①的名称是______,在操作①中所使用的玻璃仪器的名称是__________;
(4)反应②的化学方程式为________________________;
(5)反应③的离子方程式为________________________;
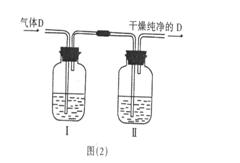
(6)在实验室中,如要获得干燥纯净的气体D,可以将它通过如图(2)的装置,其中瓶I中盛放的试剂是____________,瓶II中盛放的试剂是____________。
三、实验题(本题包括2小题,共15分)
24、(8分)实验室配制500mL0.5mol/L的NaCl溶液,有如下操作步骤:
①把称好的NaCl晶体放入小烧杯中,加入适量的蒸馏水溶解;
②把①所得溶液小心转入500mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1—2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯2—3次,每次洗涤的液体都小心用同一玻璃棒引流转入容量瓶并轻轻摇匀;
⑤将容量瓶塞紧瓶塞,充分摇匀。
回答下列问题:
(1)本实验操作步骤的正确顺序是(填序号)_______________________________;
(2)本实验用到的基本仪器有____________________________________________;
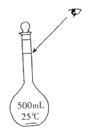
![]() (3)某同学观察液面的情况如图所示,对所配溶液有何影响?____________(填“偏高”、“偏低”或“无影响”,下同)
(3)某同学观察液面的情况如图所示,对所配溶液有何影响?____________(填“偏高”、“偏低”或“无影响”,下同)
(4)若未进行操作④,对所配溶液浓度有何影响? ______________。
25、(7分)我国规定饮用水质量标准必须符合下列要求:
| PH | 6.5—8.5 |
| Ca | <0.0045mol·L |
| 细菌总数 | <100个 ·mL |
以下是源水处理成自来水的工艺流程示意图

(1)源水中含Ca![]() 、Mg
、Mg![]() 、HCO
、HCO![]() 、Cl
、Cl![]() 等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________;
等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________;
(2)凝聚剂除去悬浮固体颗粒的过程__________(填空编号);
①只是物理过程②只是化学过程③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成_______________________沉淀;
(3)气体A的作用是______________________,这种作用是基于气体A和水反应的产物具有_________________性;
(4)下列物质中,________可以作为气体A的代用品(填写编号)。
①Ca(ClO)2 ②浓氨水 ③K2FeO4 ④SO2
四、计算题(本题包括2小题,共12分)
26、(6分)常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.17g·cm![]() 的混合溶液。
的混合溶液。
(1)该混合溶液的质量分数为______________;
(2)该混合溶液的物质的量浓度是__________mol·L![]() ;
;
(3)在1000g水中溶解____________mol NaCl才能使其浓度与上述混合溶液的浓度相等。
27、(6分)将10g铁置于40mL硝酸溶液中,再微热,反应过程随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色。充分反应后共收集到1792mL混合气体(NO、NO2 均为标准状况),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸和未被还原的硝酸的质量比;
(2)求原HNO3溶液的物质的量浓度;
(3)求混合气体中NO和NO2的体积比。
九月份月考
化学试题参考答案
一、选择题(50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | D | C | B | B | C | A | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | D | A | B | D | D | B | C | B | B |
二、填空题(23分)
21、(5分)
(1)Cl2、NH3、3:2
(2)17 3 (每空1分)
22、(8分)
(1)①Al2(SO4)3、KOH (2分)
②AgNO3、NH4Cl、KOH (3分)
(2)向生成沉淀中继续加稀HNO3,若沉淀溶解,则组成为①,若沉淀不溶解,则组成为②。 (3分)
23、(10分)
(1)Ca(OH)2
(2)向上排空气法
(3)过滤;烧杯、漏斗、玻璃棒;(每空1分)
(4)Ca(OH)2+CO2══CaCO3↓+H2O (2分)
(5)CaCO3+2H![]() ══C a
══C a![]() +CO2↑+H2O (2分)
+CO2↑+H2O (2分)
(6)饱和NaHCO3溶液,浓H2SO4 (每空1分)
三、(15分)
24、(9分)
(1)①②④③⑤ (3分)
(2)烧杯、玻璃棒、500mL容量瓶、胶头滴管、天平、药匙 (3分)
(3)高 (1分)
(4)低 (1分)
25、(7分)
(1)Mg![]() +2OH
+2OH![]() ══Mg(OH)2↓
══Mg(OH)2↓
HCO![]() +OH
+OH![]() ══CO
══CO![]() +H2O
+H2O
C a![]() + CO
+ CO![]() ══CaCO3↓
(任写一个即可,2分)
══CaCO3↓
(任写一个即可,2分)
(2)③、Fe(OH)3
(3)杀菌、消毒;强氧化性
(4)①③ (每空1分)
四、(12分)
26、(6分)
(1)20%
(2)4mol·L![]()
(3)4.27mol (每空2分)
27、(6分)
(1)2:5
(2)7mol·L![]()
(3)3:1 (每空2分)