高三化学上学期月考试题
第I卷
一.单项选择题(每题3分)Pb-207 Zn-65 Fe-56 Cl-35.5 S-32 Na-23 O-16
1、门窗紧闭的厨房内一旦发生煤气大量泄漏,极容易发生爆炸。当你从室外进入厨房嗅到极浓的煤气异味时,在下列操作中,你认为最合适的是
A.立即开启抽油烟机排出煤气,关闭煤气源 B.立即打开门和窗,关闭煤气源
C.立即打开电灯,寻找泄漏处 D.上述三者可同时进行
2、2004年化学元素家族又添新成员:113号元素Uut和115号元素Uup。已知113号元素的一种核素为![]() Uut,下列说法中正确的是
Uut,下列说法中正确的是
A.113号元素的相对原子质量为278 B.115号元素可显+3和+5价
C.![]() Uut的中子数与电子数之差为165
D.两种元素均位于周期表第八周期
Uut的中子数与电子数之差为165
D.两种元素均位于周期表第八周期
3、据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵的物质。下列说法正确的是
A.N5和N2互为同位素 B.18O2的摩尔质量为36
C.原子半径:N<18O D.2N5 = 5N2是化学变化
4、下列关于盐的反应规律的说法中不正确的是
①盐和酸反应一定生成另一种盐和另一种酸②盐和碱反应一定生成另一种盐和另一种碱③两种盐反应一定生成另外两种盐 ④阳离子相同的两种盐一定不能发生反应
A.只有② B.只有③ C.只有①④ D.①②③④
5、下列叙述正确的是
A. 48gO3气体含有6.02×1023个O3分子
B. 常温常压下,46gNO2气体含有6.02×1023个NO2分子
C. 1L 0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D. 标准状况下,33.6LH2O含有9.03×1023个H2O分子
6、已知下列物质氧化H2SO3时,自身发生如下变化:
Cl2→2Cl-,MnO4-→Mn2+ ,Cr2O72-→2Cr3+,H2O2→2H2O。如果分别用等物质的量的这些物质氧化足量的H2SO3,得到H2SO4最多的是
A.Cr2O72- B.Cl2 C.MnO4- D.H2O2
7、请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A. 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B. 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C. 一定条件下,金属钠可以成为绝缘体
D. 一定条件下,水在20℃时能凝固成固体
8、有关物质燃烧时火焰颜色描述错误的是
A. 氢气在氯气中燃烧-苍白色 B. 钠在空气中燃烧——黄色
C. 乙醇在空气中燃烧——淡蓝色 D. 硫在氧气中燃烧——绿色
9、下列说法或表示正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由单质A转化为单质B是一个吸热过程,由于可知单质B比单质A稳定
C.稀溶液中:H+(aq)+OH-(aq) ![]() H2O(l);
△H=-57.3kJ/mol,若将含0.5molH2SO4
H2O(l);
△H=-57.3kJ/mol,若将含0.5molH2SO4
的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,H2燃烧的热化学方程式为:2H2(g)+O2(g) = 2H2O(l); △H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol
10、在给定的四种溶液中,加入以下各种离子,各离子一定能在原溶液中大量共存的是
A.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-
B.pH为11的溶液:S2-、SO32-、SO42-、Na+
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.无色溶液:K+、CO32-、NO3-、Al3+
11、对于Zn(s)+H2SO4(l) = ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
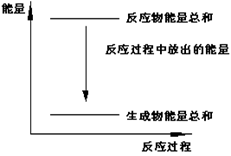 A.反应过程中能量关系可用右图表示
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
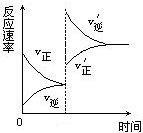 12对达到平衡状态的可逆反应X+Y
12对达到平衡状态的可逆反应X+Y![]() Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
 二.不定项选择(每题3分,错选得0分,漏选得2分)
二.不定项选择(每题3分,错选得0分,漏选得2分)
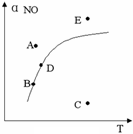
13、在其它条件一定时,图中曲线表示反应
2NO(g)+ O2(g) ![]() 2NO2(g) △H>0
达平衡时NO的转化率与温度的关系如图,标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
2NO2(g) △H>0
达平衡时NO的转化率与温度的关系如图,标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
A.A或E B.B点
C.C点 D.D点
14、对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,平衡时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
15、T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
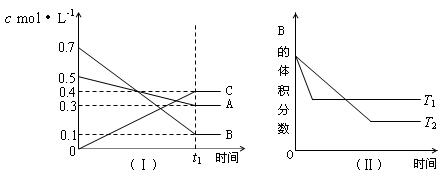
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
16、下列说法正确的是
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C. Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D. 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
17、三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A. 可用铁作阳极材料
B. 电解过程中阳极附近溶液的pH升高
C. 阳极反应方程式为: 2Cl- - 2e- = Cl2
D. 1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
18、设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下11.2L的甲烷气体含有甲烷分子数为0.5NA个
B. 14g乙烯和丙烯的混合物中总原子数为3NA个
C. 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D. 5.6g铁与足量的稀硫酸反应失去电子数为0.3NA个
19、用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
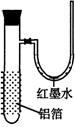 A. 实验中发生的反应都是氧化还原反应
A. 实验中发生的反应都是氧化还原反应
B. 铝是一种较活泼的金属,
C. 铝与氧气反应放出大量的热量
D. 铝片上生成的白毛是氧化铝和氧化汞的混合物
20、高温下2HBr(g) ![]() H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
A.降低温度 B.缩小体积 C.减小压强 D. 增大Br2浓度
21、下列反应的离子方程式正确的是
A. 在硫酸氢钠溶液中加入等物质的量的氢氧化钡溶液
H+ + SO42- + Ba2+ + OH-= BaSO4↓ + H2O
B. 在碳酸氢铵溶液中加入等物质的量的氢氧化钡溶液
HCO3-+OH-
+ Ba2+ =
BaCO3↓+H2O
C. 碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D. 铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
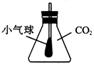 22、锥形瓶配有玻璃导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如图所示。锥形瓶内收集满二氧化碳,迅速投入下列物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是
22、锥形瓶配有玻璃导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如图所示。锥形瓶内收集满二氧化碳,迅速投入下列物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是
A. Na2O B. Mg C. NaHCO3 D. NaOH
23、往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(STP)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)
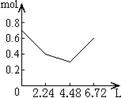
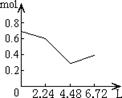
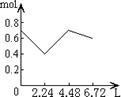
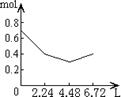
A B C D
24、新华网莫斯科2005年2月4日电:俄罗斯西伯利亚研究人员最近开发出一种生物活性吸附剂,可以吸附水中的几乎全部微生物和噬菌体。据俄《科学信息》杂志报道,这种新的吸附剂由成本低廉、环保性能好的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成。下列有关说法中不正确的是
A.Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应
B.纤维素和淀粉互为同分异构体
C.纤维素能够与醋酸发生酯化反应
D.实验室中Al(OH)3可以由偏铝酸盐和氨水制备
25、向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) ![]() CO2 +H2。
CO2 +H2。
当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2 .
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
26、镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg +
Mo3S4 ![]()
![]() MgxMo3S4
MgxMo3S4
在镁原电池放电时,下列说法错误的是
A.Mo3S4发生氧化反应
B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mg2+向正极迁移
D.负极反应为:xMg - 2xe- = xMg2+
27、接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。 2SO2(g) + O2(g) ![]() 2SO3(g) ;△H < O 。在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件SO3,采取加压措施的目的是
2SO3(g) ;△H < O 。在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件SO3,采取加压措施的目的是
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
D.高压有利于加快反应速率,可以提高生产效率
28、固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固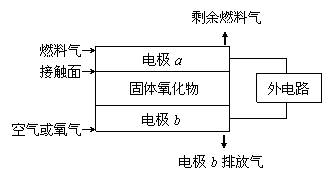 体燃料电池的有关说法正确的是
体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
29、有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
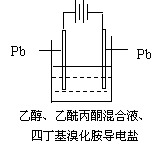
![]()
![]()
下列说法正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2 mol e—时,阴极产生2 mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e—=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol
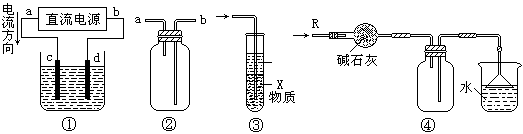 30、关于下列各装置图的叙述中,不正确的是
30、关于下列各装置图的叙述中,不正确的是
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
第II卷
31、(12分)实验室模拟合成氨和氨催化氧化的流程如下:
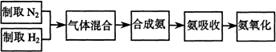
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
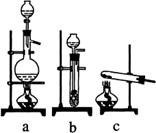
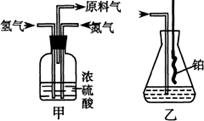
(1)从上图a、b、c中选择制取气体的合适装置:氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是:
。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
,锥形瓶中还可观察到的现象是:
。
(5)写出乙装置中氨催化氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、
、
离子。
32、(12分)某兴趣小组设计右图所示装置来改进教材中“铜与硝酸反应”实验,
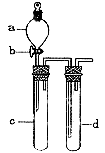 以探究化学实验的绿色化。
以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是
.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的离子方程式是
。
再由a向c中加2 mL蒸馏水,c中的实验现象是
。
(3)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2
操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
33、(8分)“碘钟”实验中,3I- + S2O82- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L- | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(SO42-)/mol·L- | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t /s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= .
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A、<22.0s B、22.0~44.0s C、>44.0s D、数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
34、(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
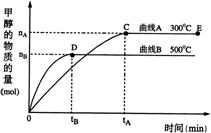 35、(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
35、(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g) 。根据题意完成下列各题:
CH3OH(g) 。根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
36(12分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1) 硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为
________________________________ _______。
(2) 用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应
方程式(忽略氧的氧化还原)为 ___________________________________;该方法的优点是____________________________________。
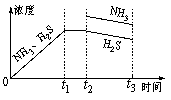
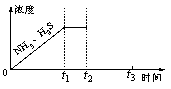
(3) 一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p(NH3)×p(H2S) = a(Pa2),则容器中的总压为_____________Pa;
②如图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在\t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
高三化学月考试题参考答案
1B 2B 3D 4D 5A 6A 7B 8D 9C 10B 11C 12A 13C 14AC 15C 16BD 17CD 18 B 19D 20BD 21AC 22AD 23D 24BD 25B 26A 27BD 28D 29CD 30A
31、(1)a、b(2)干燥气体 控制氢气和氮气的流速(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生(5)4NH3十5O2![]() 4NO+6H2O(6)NH4+ NO3-
4NO+6H2O(6)NH4+ NO3-
32、(1)检查装置气密性(2)Cu+4H+ +2NO3-=Cu2++2NO2↑+2H2O 反应变缓,气体颜色变淡。(3)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液变为黄棕色;没有处理尾气。
33、(1)研究反应物I-与S2O82-的浓度对反应速率的影响
(2)29.3s (3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
34、(1)61.6% (2)0.25 (3)4:5
35、(1)K=c(CH3OH)/c(CO)·c2(H2)
减小
(2)2nB/3tBmol·(L·min)-1
(3)b c
(4)Cu2O+CO![]() 2Cu+CO2
2Cu+CO2
36、(1)2Fe2++H2S=S↓+2Fe2++2H+
(2)Na2S+2H2O S↓+H2↑+2NaOH或S2++2H2O S↓+ H2↑+2OH-
副产氢气,生成的NaOH可循环利用。
(3) ①2/3
②