保密★启用前 试卷类型:A
高三化学上学期期中质量检测试题
高三化学试题
注意事项:
1.本试题分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,共44分;第Ⅱ卷为非选择题,共56分,满分100分,考试时间为90分钟。
2.第Ⅰ卷共4页,每小题有一个正确答案,请将选出的答案标号(A、B、C、D)涂在答题卡上。第Ⅱ卷共4页,将答案用黑色或蓝色笔写在试卷上。
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Al:27 Cl:35.5 Fe:56
第Ⅰ卷(选择题 共44分)
一、选择题(本题包括22小题,每小题2分,共44分。每小题只有一个选项符合题意。)
1.科学家最近发现两种粒子:第1种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
A.“四中子”不显电性 B.“四中子”的质量数为4
C.第2种粒子是氧元素的另一种同位素 D.第2种粒子的化学式为O4
2.下列实验能说明氮元素的非金属性较活泼的事实是
A.常温下氮气很稳定 B.氨气极易溶于水且易液化
C.硝酸易挥发 D.硝酸是强酸
3.在常温下,下列可逆反应的平衡移动伴随着颜色变化,但颜色变化不受压强变化的是:
A.2NO2![]() N2O4;
B.2NO2
N2O4;
B.2NO2![]() 2NO+O2;
2NO+O2;
C.2HI![]() H2+I2;
D.FeCl3+3KSCN
H2+I2;
D.FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl
4.下列元素一定为主族元素的是
A.最外层有3个电子的元素
B.最高正价为+7价的元素
C.最外层只有1个或2个电子的元素
D.最高价氧化物对应水化物是酸的元素
5.据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
6.下列叙述正确的是
A.同周期元素的原子半径以ⅦA族的为最大
B.同主族两种元素原子的核外电子数的差值可能为26
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
7.在体积为2L的密闭容器内合成氨,已知在时间t内,氨的物质的量增加了0.6mol,在此时间内,用氢气表示的平均反应速率是0.45mol·L–1·s–1,则t是
A.0.44s B.1s C.1.33s D.2s
8.下列反应中,属于离子反应,同时溶液又有颜色变化的氧化还原反应是
A.Al和氢氧化钠溶液反应 B.硝酸银溶液和盐酸反应
C.把铜片放入稀硫酸溶液中 D.把铁片放入氯化铁溶液中
9.化合物X、Y一定条件下发生如下反应:X+Y→Z+H2O,若Z是一种单质,Z可能是
A.Fe B.Cu C.N2 D.F2
10.向固定容积的绝热密闭容器中投入一定量A、B两种气体,发生如下反应A(g)+B(g)=2C(g),完全反应后容器内压强增大,则下列说法正确的是
A.反应后混合气体总分子数增多
B.反应后混合气体的平均相对分子质量增大
C.反应物具有的总能量小于生成物具有的总能量
D.该反应为放热反应
11.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A.X肯定为碱金属元素
B.稳定性:Y的氢化物>Z的氢化物
C.X、Y两元素形成的化合物一定为离子化合物
D.Y、Z两元素可以形成两种常见化合物
12.关于化工生产的下列叙述中,不正确的是
A.工业生产硫酸时,使用热交换器可以充分利用反应热
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.工业上金属Mg、Al都是用电解熔融的氯化物制得的
13.下列各组的两种溶液中,分别加入足量氨水,观察到的现象相同的是
A.FeCl3 AlCl3 B.NaCl BaCl2 C.MgCl2 CuCl2 D.FeCl2 FeCl3
14.根据相关化学原理,下列判断或说法中正确的是
A.若X的质子数为a,中子数为b,则X的质量数为:a—b
B.若A2 + 2D-→2A- + D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R> M
D.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
15.等物质的量的主族金属元素的单质A、B、C,分别与足量的稀盐酸反应,同条件下得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中该金属元素的化合价为
A.+1 B.+2 C.+3 D.+4
16. 在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
17.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断:
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A.只有②③正确 B.只有①③正确
 C.只有④正确
D.①②③④均不正确
C.只有④正确
D.①②③④均不正确
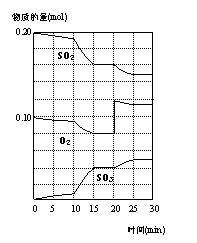
18.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生应:
![]() 2SO2(g)+O2(g) 2SO3(g);△H<O。反应过程中SO2、O2、SO3
2SO2(g)+O2(g) 2SO3(g);△H<O。反应过程中SO2、O2、SO3
物质的量变化如图,下列说法不正确的是
A.反应从0min开始,到第一次平衡时,二氧化硫的转化率为40%
B.反应进行到10min至15min的曲线变化可能升高了温度
C.反应进行至20min时,曲线发生变化是因为通入了氧气
D.在15-20min;25-30min内时反应处于平衡状态
19.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列说法正确的是
A.离子半径大小:r(M3+)>r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质可在氧气燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
20.在一固定体积的密闭容器中,有下列化学反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
其化学平衡常数K和温度T的关系如下表:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关的叙述正确的是
A.该反应正向反应为放热反应
B.在温度升高平衡移动的过程中气体压强始终保持不变
C.若绝热时(容器内外没有热量交换),平衡移动的结果使二氧化碳的浓度增大,则容器内气体的温度一定升高
D.若在某平衡状态时,c(CO2)× c(H2)= c(CO)×c(H2O),则此时的温度为830℃
21.Fe3O4粉末能与稀硝酸反应生成硝酸铁和一种无色气体A,气体A在空气中很快变成红棕色。当有116g的Fe3O4溶解时,被还原的HNO3的物质的量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
22.将一定量Na2O、Na2O2、Al组成的混合物投入足量水中,再滴加2 mol·L![]() H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为
H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为
A.无法确定 B.0.2mol C.0.4mol D.0.5mol
高三化学上学期期中质量检测试题
高三化学试题
第Ⅱ卷(共56分)
| 题号 | 二 | 三 | 四 | 总分 |
| 得分 |
| 阅卷人 | 得分 |
二. (本题包括3个小题,共18分)
23.(6分)某研究性学习小组对铝热反应实验展开研究。教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(1) 某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
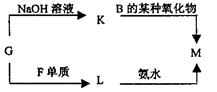
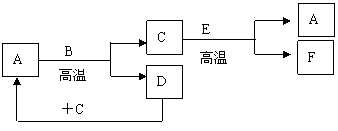 24.(6分)如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物。按要求回答下列问题:
24.(6分)如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物。按要求回答下列问题:
(1)E在元素周期表中位于第 周期;第 族
(2)写出A和B反应的化学方程式: 。
(3)C和E反应的化学反应方程式为
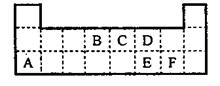
25.(6分)下表是元素周期表的一部分。表中所列的字母分别代表某一元素。
|
(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 。
(2)写出B的最高价氧化物的电子式 。
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化
|
其中化合物M是一种白色胶状沉淀,则M为(填化学式) ;
K的溶液与B的某种氧化物反应的化学方程式为 ;
一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
| 阅卷人 | 得分 |
三. (本题包括3个小题,共21分)
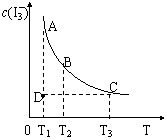 26.(9分)(1)实验室若配制浓度较大的碘水,一般是将I2溶于KI溶液中,原因是发生了如下反应: I2(aq)+I-
26.(9分)(1)实验室若配制浓度较大的碘水,一般是将I2溶于KI溶液中,原因是发生了如下反应: I2(aq)+I-![]() -3。由于c(-3) 远大于c(I2) ,所以该溶液的颜色较单纯的碘水更深。上述平衡体系中,-3 的物质的量浓度c(-3)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。
-3。由于c(-3) 远大于c(I2) ,所以该溶液的颜色较单纯的碘水更深。上述平衡体系中,-3 的物质的量浓度c(-3)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。
①A状态与C状态的化学反应速率υ (A) υ(C)。
②D点所示状态,υ(正) υ(逆) 。
(2)高炉炼铁中发生的基本反应之一为:FeO+CO![]() Fe+CO2
△H>0,其平衡常数可表示为K=c(CO2)/c(CO),已知1373K时K=0.263。
Fe+CO2
△H>0,其平衡常数可表示为K=c(CO2)/c(CO),已知1373K时K=0.263。
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)
②1373K时测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
27.(6分)恒压(1.01×105Pa)下,将2molSO2与a mol O2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
![]() 2SO2(g)+O2(g) 2SO3(g),△H<0
2SO2(g)+O2(g) 2SO3(g),△H<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,
则a= ;平衡时SO2的转化率为 。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8mol。T1与T2的关系是
(选填序号)
①T1>T2 ②T1<T2 ③T1=T2
28.(6分)现有原子序数依次增大的A、B、C、D、E五种短周期元素。已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水。请回答:
(1)B元素在元素周期表中的位置是 。
(2)D、E两元素的最高价氧化物的水化物中,酸性较强的是 (填化学式)。
(3)写出A、C两元素的最高价氧化物的水化物之间反应的离子方程式:
。
(4)将A元素的一种氧化物11.7 g与足量二氧化碳完全反应,有 mol 电子发生转移。
| 阅卷人 | 得分 |
四. (本题包括3个小题,共17分)
29.(5分)主族元素R的单质可被足量稀硝酸氧化成R3+,R3+离子最外层有2个电子,在氢氧化钠溶液中,R3+可被氯气氧化成RO3-,回答下列问题:
① R元素在元素周期表中位于______族。
② R元素可能是______(填金属或非金属)。
③ 实验配制和保存RCl3溶液时,是否需要加入R单质 (填是或否),理由是___________ _。
30.(6分)Fe和Al是两种重要的金属,将它们按一定的质量比组成混合物。
(1)取一定质量的该混合物,若加入足量的NaOH溶液,生成的气体在标准状况下体积为n L;若加入足量的稀硫酸,生成的气体在标准状况下体积为m L。则原混合物中Fe的物质的量为 mol(用含n、m的代数式表示)。
(2)取一定质量的该混合物,在纯氧中充分燃烧。向所得产物中加入过量的NaOH溶液,充分反应后将不溶物过滤、洗涤、干燥后称量,测得该不溶物的质量与原混合物的质量恰好相等。则原混合物中Fe与Al的质量比为 。
31.(6分)氨是一种重要的化工产品,可用于制取硝酸、炸药、化肥等。
(1)在工业合成氨的反应中,若反应后气体的总体积减少了5040 m3(标准状况),则生成氨气的质量为 kg。
(2)硝酸工业的尾气中主要含有NO、NO2气体,工业上可用氨气进行治理,使其转化为无毒的氮气。有关反应的化学方程式为:
6NO + 4 NH3![]() 5N2 + 6H2O
5N2 + 6H2O
6NO2 + 8
NH3![]() 7N2 +
12H2O
7N2 +
12H2O
现有NO和NO2的混合气体60 L,用氨气进行处理,恰好消耗同温同压下的NH3 68 L。则原混合气体中NO与NO2的物质的量之比为 。
高三化学上学期期中质量检测试题
高三化学试题参考答案
1~5:CDDAD 6~10:BBDCD 11~15:DDBDA 16~20:BDABD
21~22:AB
(选择题每题2分,共44分 )
23.(6分)⑴合理 (1分) ⑵NaOH溶液(1分) 2A1+2OH-+6H2O
2[Al(OH)4]-+3H2↑ (2分) ⑶B (2分)
24.(6分)(1)三;(1分) III A (1分) (2)3Fe +4 H2O(g)![]() Fe3O4
+ 4H2 (2分)
Fe3O4
+ 4H2 (2分)
(3)3Fe3O4
+ 8Al![]() 4Al2O3
+ 9Fe(2分)
4Al2O3
+ 9Fe(2分)
|
|
(1)11.2L(1分) (2) O::C::O (1分)
(3)Al(OH)3(1分)
2Na[Al(OH)4]+CO2=2Al(OH)3↓+Na2CO3+2H2O(2分)
(或2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3)
或Na[Al(OH)4]+CO2=Al(OH)3↓+NaHCO3
(NaAlO2+CO2+2H2O= Al(OH)3↓+NaHCO3)
AlN(1分)
26.(9分)
(1)①<(2分) ②>(2分)
(2)①增大(1分)
②否(1分),大于(1分),此时c(CO2)/c(CO)=0.25<k,反应向右进行(2分)
27.(共6分,每空2分)
(1)3.65 65%
(2)①
28.(6分)(1)第三周期ⅡA族 ……………………………………………………1分
(2)HClO4 ……………………………………………………………1分
(3)Al(OH)3+OH-=[Al(OH)4]-(或AlO2-+2H2O) …………………2分
(4)0.15 ……………………………………………………………2分
29.(5分)(1)①VA;(1分)②金属;(1分)③否;(1分)R被足量硝酸氧化成R3+,说明R3+很稳定,不容易被氧气氧化。(2分)
30.(6分)(1)![]() …………3分
…………3分
(2)21∶8 …… ……3分
31.(6分)
(1)3825 …………… 3分
(2)3:7 ……… …… 3分