08届高三理综化学上学期期中试题
可能用到的相对原子质量:H1 C:12 N:14 O:16 Na::23 Mg:24 Al:27 S:32 Fe:56 Ag:108 Cl:35.5
6. 在浅绿色的Fe(NO3)2溶液中主要存在的平衡是Fe2++2H2O![]() Fe(OH)2+2H+,现向该溶液中加入少量的稀盐酸,溶液颜色的变化应该是 ( )
Fe(OH)2+2H+,现向该溶液中加入少量的稀盐酸,溶液颜色的变化应该是 ( )
A. 几乎不变化 B. 绿色加深 C.绿色变浅 D. 溶液变黄
7. 在含有8.0g NaOH的烧碱溶液中通入一定量的硫化氢气体后,将得到的溶液小心蒸干,称得无水物质量为7.9g,则此无水物中一定含有的物质是 ( )
A. Na2S B. NaOH和NaHS C. Na2S和 NaHS D. NaHS
8. 同周期的主族元素中,相邻主族原子序数相差最大的是 ( )
A. 在短周期中 B. 在长周期的第ⅠA族第ⅡA族
C. 在长周期的第ⅡA族第ⅢA族 D. 在第四周期中
9. 2a%的硝酸溶液与4a%的硝酸溶液等体积混合均匀,所得混合液的密度为dg/mL,则此时溶液中溶质的物质的量浓度为 ( )
A. 无法确定 B. =30da/63 mol/L
C. <30da/63 mol/L D. >30da/63 mol/L
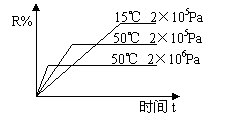 10.在密闭容器中进行下列反应:M(g)+N(g)
10.在密闭容器中进行下列反应:M(g)+N(g) ![]() R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是
( )
R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是
( )
A. 正反应为吸热反应,X为气体
B. 正反应为吸热反应,X为固体或液体
C. 正反应为放热反应,X为气体
D. 正反应为放热反应,X为固体或液体
11. 在1LK2 SO4 和CuSO4的混合溶液中,c(SO42-)= 2.0mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标况下的)气体,则原溶液中K+的物质的量浓度为 ( )
A. 2.0mol/L B. 1.5 mol/L C. 1.0mol/L D. 0.5mol/L
12. 下列有关阿伏加德罗常数的叙述正确的是( )
A.0.1mol碳酸钠晶体中所含阴离子数小于0.1×6.02×1023个
B.通常状况下,0.5×6.02×1023个甲醛分子所占体积大于11.2L
C.1mol冰醋酸中含有6.02×1023个CH3COO-
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
13.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:
![]() Ca(OH)2(s) Ca2+(aq)+2OH-(aq)下列说法正确的是( )
Ca(OH)2(s) Ca2+(aq)+2OH-(aq)下列说法正确的是( )
A.恒温下向溶液中加Ca(OH)2,溶液的pH升高
B. 给溶液加热,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,其中固体质量增加
D. 向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
26.(18分)下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。
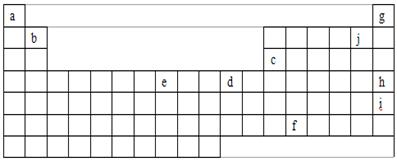
(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_________,其原因是__________________________________。
(2)e是周期表中的_________族元素,最外层电子数为_______。
(3)a的阴离子半径____b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)_______________ ______;______________________ ______。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为______________________________________。
(6)元素周期表第6周期中的镧系元素共有 种,它们原子的电子层结构和性质十分相似。
27. (12分) 27.(12分)若不考虑空气等因素的影响,试计算:
(1)将10g铁粉加入到50mL 2mol·L—1的稀硫酸中,充分反应后生成硫酸亚铁的物质的量为 。
(2)将ag生铁(成分是Fe和C)加入到b mL 2 mol·L—1的稀硫酸中,充分反应后生成氢气c L(标准状况),溶液中有黑色固体剩余。再加入少量稀硫酸,黑色固体不溶解,则生铁中Fe的质量分数是 (用代数式表示)。
(3)将ag处理过的废铁屑(成分是Fe和Fe2O3)加入到b mL 2mol·L—1的稀硫酸中,生成氢气c L(标准状况)。充分反应后生成硫酸亚铁的物质的量取值范围为:
<n(FeSO4)≤ (用代数式表示)。
28.(18分)某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品![]() ,并溶于蒸馏水。
,并溶于蒸馏水。
② 。
③过滤。
④ 。
⑤将沉淀烘干、称量,测得固体质量为![]() 。
。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器有 。
②检验沉淀是否洗净的方法是 。
③烘干沉淀应采取的方法是
A、低温烘干 B、高温烘干 C、利用太阳能烘干
④若味精包装上标注:“谷氨酸钠含量![]() ,
,![]() 含量
含量![]() ,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
29. (12分)
阅读下面的信息,推断元素及有关物质,按要求回答问题:
| 信 息 | 问 题 |
| ①X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。 | 根据信息①,X一定不是 _____ _ __(填序号)。 A.氢 B.碳 C.氧 D.硫 |
| ②上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。 | 这四种元素中是否可能有一种是铝元素?(填“可能”或“不可能”) ______________ |
| ③向上述四种元素单质组成的混合物中加入足量盐酸溶液、固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀 | 白色沉淀物的化学式为: ___________ ___ |
| ④向上述四种元素单质组成的混合物中加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。 | 生成白色沉淀的离子方程式为: _______________________________ |
| ⑤X与W同主族。 | X与浓硫酸反应的化学方程式为: _______________________________ |
化学参考答案
6.D 7.A 8.C 9.D
10.C 11.A 12. B 13.C
26(共18分,每空2分)
(1)i 从上到下,原子半径增大,失去电子越来越容易
(2)VIII;2
(3)大于
(4) Be2++2OH-=Be(OH)2↓ Be2++ 4OH-=BeO22-+2H2O
(5)PbO2+4HCl=PbCl2+Cl2 ↑+2H2O (6)15
27(12分)
(1)0.1mol …………4分 (2)![]() …………4分
…………4分
(3)![]() mol<n(FeSO4)
mol<n(FeSO4)![]() mol …………4分
mol …………4分
28.(18分)
(1)加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全。(3分)
用蒸馏水反复洗涤沉淀多次 (3分)
(2)①仪器有:烧杯,漏斗,铁架台(带铁圈),玻璃棒,滤纸
(4分)
②取少量洗出夜,向其中加入稀盐酸,若无沉淀或浑浊出现,证明沉淀已洗净 (3分)
③A (2分)
④不符合 (3分)
29.(12分)
(①②③每空2分,④⑤每空3分)
① A (2分)
②可能 (2分)
③Mg(OH)2 (2分)
④SiO32-+2H+ ===H2SiO3↓ (3分)
⑤C+2H2SO4===CO2↑+SO2↑+2H2O (3分)