08 届高中毕业班化学摸底测试
化 学
本试卷分第 1 卷(选择题)和第 II 卷(非选择题)两部分。第 I 卷第 1 页至 4 页,第 II 卷 5 页至 8 页。满分 100 分,考试时间 100 分钟。
第I卷(选择题,共 44 分)
注意事项:
1.答第 I 卷前,考生务必将自己的姓名、考号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束,监考人将本试卷和答题卡一并收回。
可能用到的相对原子质量: H一1 C一12 N一14 O一16 Na一23 K 一 39 Fe一56 Cu一64 Ag一108
本卷共 22 题,每题 2 分,共 44 分。下列各题给出的四个选项中只有一个选项符合题意。
1.某有机小分子化合物含有 C 、 H 、 O 、 N 四种元素,该有机物可能是
A.月旨肪 B.葡萄糖 C.蛋白质 D .氨基酸
2.下列化学用语正确的是
A.C2H4——乙烯的最简式 B.C2H6O——乙醇的结构简式
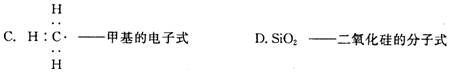
3.下列有关环境保护的说法错误的是
A.含 N 、 P 的化合物大量排放可使水体富营养化而产生“水华”现象
B.为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少 CO2的工业排放量
C.甲醛、苯等是房屋装修中常见的污染物,对人体有害
D.废旧电池的集中处理是为防止电池中的汞等重金属污染土壤及水体
4.物质的量浓度相同的下列溶液中, NH4+浓度最大的是
A.NH4Cl B.NH4HSO4
C.CH3COONH4 D.NH3·H2O
5.下列有关比较中,大小顺序不正确的是
A.热稳定性: PH3 > H 2S > HCl > NH3
B.物质的熔点:石英>食盐>冰>汞
C.结合
H十的能力:![]()
D.分散系中分散质粒子的直径:Fe ( OH )3悬浊液> Fe ( OH ) 3 胶体> FeC13溶液
6.下列离子方程式正确的是
A.甲酸与氢氧化钠溶液反应:H++OH-===H2O
B.氯气通人冷的氢氧化钠溶液中![]()
C.铝片投人氢氧化钠溶液: ![]()
D.在 Ca ( HCO3 )2溶液中加人过量 NaOH 溶液:
![]()
7.下列各种物质在一定条件下都能跟水反应的是
① 铁、木炭、纤维素
② 镁、硫磺、乙酸乙醋
③ 淀粉、蛋白质、氨基酸
④ 氯气、乙炔、乙烯
⑤ 硫化铝、硫铁矿、蔗糖
A. ① ④ B. ② ③ C. ① ⑤ D. ① ③ ④ ⑤
8.下列各组离子中能大量共存,且加人过量 NaOH 溶液或适量稀 H2SO4都能产生白色沉淀的是
![]()
9.A 、 B 、 C 、 D 、 E 是同一周期的五种主族元素, A 和 B 的最高价氧化物对应的水化物均呈碱性,且碱性 B > A , C 和 D 的气态氢化物的稳定性 C > D , E 是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A.A 、 B 、 C 、 D 、 E B.E 、 C 、 D 、 B 、 A
C.B 、 A 、 D 、 C 、 E D.C 、 D 、 A 、 B 、 E
10.工业上用固体硫酸亚铁制取颜料铁红( Fe2O3) ,反应原理是:
![]()
某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I) BaCl2溶液、 ( II ) x 溶液、(III) NaOH 溶液的三个装置。则下列对该方案的评价中正确的是
A.( I )中会生成 BaSO3、 BaSO4两种沉淀
B.可将( I )中的 BaCl2溶液改为 Ba ( NO3 )2溶液
C. (II)所盛 x 应为品红溶液
D. ( III)的作用是检验生成的SO2 气体
11.用 0.1 mol· L一1盐酸分别跟 20 mL NaOH 溶液及 20 mL 氮水完全反应,都消耗 20 mL 盐酸。则 NaO H 溶液与氨水的关系是
A.c (OH一)相同且 B.pH相何
C.电离程度相同 D.物质的量浓度相同
12.下列说法正确的是
A.离子化合物中一定含有金属元素
B.构成分子晶体的粒子中一定含有共价键
C.只有离子晶体中才存在禽子
D.构成原子晶体的粒子是相同或不同的原子
13.下列实验中,仪器的下端必须插人液面下的是
① 制备氢气的简易装置中用来加人稀硫酸的长颈漏斗
② 实验室用 MnO2和浓盐酸制备氯气装置中的分液漏斗
③ 用新制的 FeSO4溶液和 NaOH 溶液制备 Fe ( OH )2操作中的胶头滴管
④ 将氯气溶于水制取氯水时的导气管
⑤ 蒸馏石油时的温度计
A.③ ⑤ B.① ③ ④ C.② ④ ⑤ D.全部
14.以 NA 表示阿伏加德罗常数,下列说法正确的是
A.如果 5.6 LN2含有 n 个氮分子,则阿伏加德罗常数一定为 4n
B.1 L 1 mol·L一1的 FeCl3溶液中含有铁离子的数目为 N A
C.1 mol 苯中含有 3NA 个 C=C 双键
D.46g NO2与 N2O4的混合物中含 3 NA 个原子
15.有如下几种制备气体的方案:
① 加热稀硫酸和乙醇制备乙烯,
② 用水与过氧化钠固体反应制氧气,
③ 用稀硫酸和大理石制备二氧化碳,
④ 氧化钙与浓氨水反应制氨气,
⑤ NaI固体和浓硫酸混合共热制碘化氢;
⑥ 电石与饱和食盐水制乙炔。不宜采用的方案有
A.仅 ① ③ ⑤ B.仅 ① ② ③
C.仅 ③ ④ D.全部
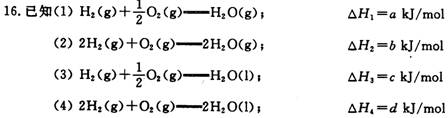
下列关系式中正确的是
A .2a = d < 0 B.b > d > 0 C.2a = b < 0 D.2c = d > 0
17.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式
![]()
A.方框中的物质应为 Cu2S
B.O2只作氧化剂
C.SO2 既是氧化产物又是还原产物
D.若有 1 molSO2 生成,则反应中有 4 mol 电子转移
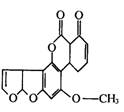 18.霉变的大米、花生中含有黄曲霉素,黄曲霉素的结构如图所示。下列说法中不正确的是 A.霉变的大米、花生等绝对不能食用
18.霉变的大米、花生中含有黄曲霉素,黄曲霉素的结构如图所示。下列说法中不正确的是 A.霉变的大米、花生等绝对不能食用
B.l 个黄曲霉素分子中至少有 8 个碳原子共平面
C.1 mol 该化合物能与 7 molH2发生加成反应
D.1 mol 该化合物与 NaOH 溶液反应,最多消耗 2 mol NaOH
19.14g 铜、银合金与足量的某浓度的硝酸反应,将生成的气体与 1.12L (标准状况下)氧气混合,通人水中恰好全部被吸收,则合金中铜的质量为
A.3.2g B.1.6g C.9.6 g D.6.4g
20.已知某溶液中存在 OH一、 H+、 NH4+和 Cl一四种离子,其浓度大小有如下关系。其中不可能的是
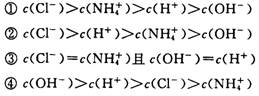
A.① ② B.② ③ C.③ D.④
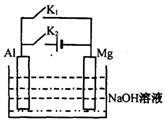 21.将
Mg 条、 Al 条平行插人一定浓度的 NaOH 溶液中,如图所示用导线连接起来。下列叙述符合事实的是
21.将
Mg 条、 Al 条平行插人一定浓度的 NaOH 溶液中,如图所示用导线连接起来。下列叙述符合事实的是
A.断开 K2,闭合 K1时, Al 电极反应为:
Al+ 4OH-一3e一===AlO2-+ 2H2O
B.断开 K2,闭合 Kl 时,由于 Mg 比 Al 活泼,故 Mg 失去电子被氧化成 Mg2+
C.断开 K1,闭合 K2时,电子由 Mg 向 Al 流动
D.断开 Kl ,闭合 K2时,溶液中立即会有白色沉淀析出
22.某学生用 NaHCO3和 KHCO3 组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理不正确的是
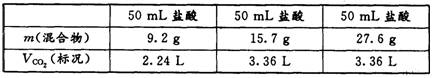
A.盐酸的物质的量浓度为 3.0 mol · L 一1
B.根据表中数据不能计算出混合物中 NaHCO3的质量分数
C.加人混合物 9.2g 时盐酸过量
D.15.7g 混合物未与盐酸完全反应
第 II 卷(非选择题,共 56 分)
注意事项:
1.第II卷共 4 页,用钢笔或圆珠笔直接答在试卷上。
2.答卷前将密封线内的项目填写清楚。
23.( 9 分)
已知 A 、 B 、 C 、 D 为原子序数依次增大的四种短周期元素,最外层电子数均小于 8 ,其中只有 B 是金属元素。 A 元素的原子最外层电子数是次外层的 3 倍,且 A 与 B 可形成原子个数比分别为 1:1 和 1:2 的两种化合物, A 与 D 的原子序数之和等于 B 与 C 的原子序数之和。请回答下列问题:
( 1 ) B 、 D 的元素符号分别是: B_________ , D________
( 2 ) A 与 C 形成的化合物属于_________晶体; C 与 D 形成的化合物的电子式是:
________________________
( 3 )写出 A 、 B 形成的化合物与 CO2发生氧化还原反应的化学方程式:
________________________________________________________________。
( 4 ) A 、 B 、 C 形成的化合物的水溶液的 pH_______7 (填“ > " , " =”或“ < ” ) ,原因是___________________________________________________________(用文字表述)。
24.( 10 分)
某含有少量 FeCl2杂质的 FeCl3样品,现要测定其中铁元素的含量.实验步骤如下:
① 准确称量mg 样品;
② 向样品中加人 10 mL 5 mol · L一1的盐酸,再加人蒸馏水,配制成 250 mL 溶液; ③ 量取 25 mL 操作 ② 中配得的溶液,加人 3 mL 溴水,加热使之完全反应;
④ 趁热迅速加人质量分数为 10 %的氨水至过量,充分搅拌,使之完全沉淀;
⑤ 过滤,将沉淀洗涤后反复灼烧、冷却、称量至恒重。
请根据上面的叙述回答:
( l )溶解样品时要加人盐酸,其目的是_______________________________________
( 2 )配制 250 mL 溶液时,除需玻璃棒、烧杯外,还须用到的玻璃仪器是__________
________________________________________________
( 3 )加人溴水时发生反应的离子方程式是:
____________________________________________________
( 4 )若坩埚质量为 W1 g ,增锅与灼烧后固体的总质量是 W2 g ,则样品中铁元素的质量分数是_____________________________
25.( 9 分)
下图中 A 至 I 分别表示化学反应中的一种常见物质,工业上常用电解 A 的饱和溶液的方法制取 B 。其中 E 、 F 、 J 在通常情况下是气体单质, E 为有色气体, J 是空气中含量最多的气体, X 是一种常见的金属单质。部分产物和反应条件略去。
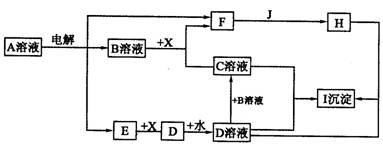
填写下列空白:
( l )写出 A 溶液电解的化学方程式:_______________________________________
( 2 )若将 a mol D 全部转化为 C ,则 B 的物质的量的取值范围为______________
( 3 ) C + D →I 的离子反应方程式为_______________________________________
(
4 )一定条件下, H 可进行如下转化:![]() 。将 K 溶液逐滴滴人 C 溶液至过量,可观察到的现象是_______________________________________
。将 K 溶液逐滴滴人 C 溶液至过量,可观察到的现象是_______________________________________
___________________________________________________________________________。
26.( 7 分)
在一定条件下,将 2 molA 和 2 molB 混合于容积为 2L 的密闭容器中,发生如下反应: 3A ( g ) + B ( g )![]() xC ( g
) + 2D ( g )。 2 min 末反应达到平衡状态时,生成 0.8molD ,同时测得
C 的浓度为 0.4 mol·L一1。请填写下列空白:
xC ( g
) + 2D ( g )。 2 min 末反应达到平衡状态时,生成 0.8molD ,同时测得
C 的浓度为 0.4 mol·L一1。请填写下列空白:
( 1 ) x =_________;用 D 的浓度变化表示的化学反应速率为___________________
( 2 ) A 的平衡浓度为_______________________ , B 的转化率为_____________。
( 3 )如果增大体系的压强,则平衡体系中 C 的体积分数将__________________(填“增大”、“减小”或“不变”)。
( 4 )如果上述反应在相同条件下从逆反应开始进行,起始时加人 C和 D 各 mol ,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加人___________物质______mol
27.( 6 分)
某温度时,测得 0.01 mol · L一1氢氧化钠溶液的 pH=11 。
( 1 )则该温度下水的离子积( Kw ) =______________________________
( 2 )在此温度下该溶液中由水电离出的 H十的物质的量浓度为_________ mol·L一1
( 3 )在此温度下,将 p=a的氢氧化钠溶液VaL 与 pH = b 的 H2SO4溶液VbL 混合,若所得溶液为中性,且 a =12 , b = 2 ,则 Va:Vb===_________________。
28.( 15 分)
已知 X 是二氢香豆素类化合物,是香料工业的重要化合物。 X 可以通过下列途径合成。
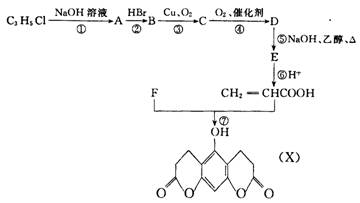
请根据上图回答:
( 1 ) D 中含有的官能团名称是_________、__________;反应 ① 属于______反应;反应 ③ 属于__________反应。
( 2 )化合物 B 的结构简式为 ______________________或_______________________
( 3 )写出反应 ⑤ 的化学方程式(有机物写结构简式,下同)
________________________________________________________________________
( 4 )化合物 F 的分子式为 C6H6O3,它具有酸性, F 中只有 2 种等效氢原子。写出反应 ⑦ 的化学方程式:
______________________________________________________________________
( 5 )化合物 Y 是 X 的同分异构体, Y 具有如下特点:a.苯环上有两种取代基; b.苯环上的一氯代物只有两种;c.能跟 FeC13 溶液发生显色反应,且 1 molY能与 3mo1 NaOH 发生反应。写出符合上述特点的 Y 的结构简式__________________________。(任写一种)
化学试题参考答案及评分意见
第I卷(选择题,共 44 分)
1.D 2.C 3.B 4.B 5.A 6.C 7.A 8.D 9.C 10.C
11.D 12.D 13.B 14.D 15.A 16 .C 17.D 18.C 19.A
20.D 21.A 22.B
第II卷(非选择题,共 56分)
23.( 9 分)
( 1 ) Na Cl (各 1 分)
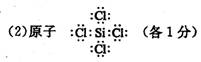
![]()
( 4 ) > ( 1 分) Na2SiO3水解后显碱性(或 SiO32-水解显碱性) ( 2 分)
24.( 10 分)
( 1 )抑制 Fe2+、 Fe3 +水解( 2 分)
( 2 ) 250mL 容量瓶、胶头滴管、量筒(各 1 分)
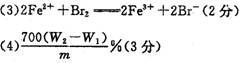
25.( 9 分)
(
1 ) 2NaCl + 2H2O![]() Cl2↑+ H2↑+ 2NaOH (2分)
Cl2↑+ H2↑+ 2NaOH (2分)
( 2 ) ) ≥4a ( 2 分)
( 3 ) 3 AlO2-+ Al3+ 十 6H2O====4Al (OH)3↓( 2 分)
( 4 )先出现白色沉淀,白色沉淀逐渐增多再慢慢减少,最后消失(3分)
26.( 7 分)
( l ) 2 ( 1 分) 0.2 mol / ( L·min ) ( 1 分)
( 2 ) 0.4 mol . L一1, ( 1 分) 20%( l 分)
( 3 )不变( 1 分)
( 4 ) B ( 1 分) ( 1 分)
27.( 6 分)
( 1 )1×10一13 ( 2 分)
( 2)1×10一11 ( 2 分)
(3)1:10 ( 2 分)
28.( 15 分)
( 1 )羧基 溴原子(各 1 分) 取代( 1 分) 氧化( 1 分)
( 2 ) CH3CHBrCH2OH CH2BrCH2CH2OH
(各 2 分)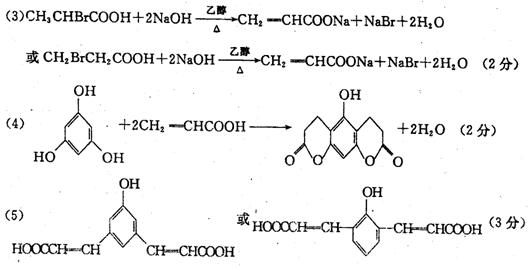
说明: 1.本试卷中要求书写的化学方程式,全对才给分。
2.其它合理答案参照此评分意见给分。