高三化学上学期第二次月考试卷
班级 姓名 学号 成绩
第一卷选择题(共57分)
一、选择题(本题共10小题,每题只有一个正确答案,每题3分,共30分)
1、下列说法正确的是
A.钢铁发生电化腐蚀的正极反应式:Fe-2e-== Fe2+
B.氢氧燃料电池的负极反应式:O2 +2H2O +4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-==Cl2↑
2、已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-。若在某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是
A. Br- B. Cl- C. OH- D. S2-
3、下列说法正确的是
A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同
B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7
C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7
D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡
4、元素的性质包含金属性和非金属性,其强弱可以通过该元素对应的某些化学性质体现出 来。某同学认为铝元素是金属元素,但是有一定的非金属性。下列化学反应中,你认为能支持该同学观点的是( )
A.铝片与盐酸反应生成氢气 B.氢氧化铝溶于强碱溶液
C.氢氧化铝溶于强酸溶液 D.铝热反应
5、类推的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,因此类推出的结论最终要经过实践的检验才能确定是否正确。以下几种类推结论中正确的是
A.CaCO3的溶解度小于Ca(HCO3)2,推出Na2CO3溶解度小于NaHCO3
B.NH3的沸点高于PH3,推出CH4沸点高于SiH4
C.H2SO4为强酸,推出HClO4为强酸
D.碳的+4价化合物稳定,推出铅的+4价化合物稳定
6、下列有关化学实验的操作或说法中,正确的是
A.配制氯化铁溶液时,先将氯化铁溶于浓盐酸,再用蒸馏水稀释并加入适量铁粉
B.用加热法测定硫酸铜晶体中结晶水含量时,若在空气中冷却会使结果偏低
C.将浓硫酸在量筒中稀释
D.将锌粒投入CuSO4溶液中充分反应后,固体质量一定增加
7、下列4组连线中,完全正确的一组是( )
A. B.
B.
C. D.
D.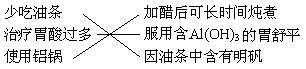
8、下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是:①碳酸钠溶液与盐酸;②偏铝酸钠溶液与盐酸;③苯酚钠溶液和CO2;④硝酸银溶液和氨水;⑤氯化铝溶液与氨水;⑥碳酸氢钠溶液与澄清的石灰水。
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
9、应用纳米新材料能给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用。鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去。有若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有
A.4种 B.5 种 C.6种 D.8种
![]() 10、下列表达方式正确的是 ﹙ ﹚
10、下列表达方式正确的是 ﹙ ﹚
A、二氧化碳 ![]() B、N原子的轨道表示式写成
B、N原子的轨道表示式写成
![]() C、Fe2+离子的核外电子排布式1s22s22p63s23p6 3d6
或[Ar]3d6
C、Fe2+离子的核外电子排布式1s22s22p63s23p6 3d6
或[Ar]3d6
D、NH4H的电子式是NH4 H
二、选择题(本题共9小题,每题有1-2个正确答案,每题3分,若有2个答案选对得3分,少选得1分,多选、错选、不选得0分,共27分)
11、已知常温下:Ksp[Mg(OH)2]=1.2×10-11mol3•L-3 Ksp(AgCl)=1.8×10-10mol2•L-2
Ksp(Ag2CrO4)=1.9×10-12mol3•L-3 Ksp(CH3COOAg)=2.3×10-3mol2•L-2 下列叙述正确的是
A、等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B、将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
C、在Mg2+为0.121mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
 D、向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
D、向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
12、如图,在注射器中加入少量Na2SO3晶体,并吸 入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的 是
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色证明了SO2漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
13、下列说法中,正确的是 ( )
A.NO2、BF3、NC13分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.F4和CH4都是正四面体分子,两种分子中化学键之间的夹角相等且均为109°28′
C.(NH4)2SO4晶体中只有离子键
D.由原子间通过共价键而形成的晶体具有高熔、沸点及硬度
14、用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.46g四氧化二氮含有的原子总数为3NA
B.20gD2O中含有D—O键的数目为NA
C.100mL、1mol/L的乙酸溶液中含有H+数为0.1NA
D.2molFeC13制成胶体,所得胶体的胶粒数为2N
15、下列离子方程式正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D.向NaHCO3 溶液中加入过量Ca(OH)2 溶液
2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-
16、电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
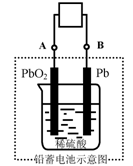 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由B到A
B.放电时:正极反应是Pb-2e-+SO42-![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O![]() PbO2+SO42-+4H+
PbO2+SO42-+4H+
17、常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(Ac—)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)
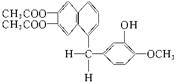 18、鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
18、鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
1mol该化合物完全燃烧耗O2的物质的量、与NaOH溶液作
用消耗NaOH的物质的量、其苯环上的一溴代物的种数分别是
A.26 mol、4 mol、7 B.24 mol、4 mol、8
C.26 mol、5 mol、7 D.24 mol、5 mol、8
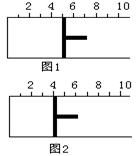
![]() 19、如右图所示,一定条件下将1mol
A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平
19、如右图所示,一定条件下将1mol
A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平
衡时,活塞位置如图2所示,则平衡时A的转化率是
A.20% B.40% C.60% D.无法确定
第二卷非选择题(共63分)
三、必修(本题共三小题,共24分)
20、某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
5 Fe2+ +5C2O42—+3MnO4—+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42—)== ;
FeC2O4 的质量分数为 (精确到0.01%)
(1)重复以上实验1—2次(2分)
(2)用高锰酸钾标准溶液润洗滴定管(2分)
(3)KSCN(1分),溶液中没有出现血红色(1分)
(4)n(Fe2+)==0.001110mol(1分) n(C2O42—)==0.001010mol(1分)
FeC2O4 的质量分数为73.81%(2分)
21、W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
。
(1)H、C、O、Na(各1分,共4分)
(2)2和4(1分),σ键,π键
(3)NaHCO3(1分),因为HCO3—中含有O—H键,相互之间可通过O—H┅O氢键缔合(2分)
22、(1)下表列有四种物质的沸点
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
①从表中的数据,结合学过的化学知识,你能得到的规律是 。
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
(1)①第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。(2分) ②SiCl4、AlCl3(2分) ③ ﹥(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③ ﹤(1分)
四、本题共两小题
23、有机粘合剂的粘合过程一般是液态的小分子粘合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α—氰基丙烯酸乙酯(![]() ),请写出“502胶”发生粘合作用的化学方程式:
),请写出“502胶”发生粘合作用的化学方程式:
| |
(3)白乳胶是常用的粘合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如![]() 。已知含有
。已知含有![]() 结构的物质不能稳定存在。请另外任写其3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
;
结构的物质不能稳定存在。请另外任写其3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
;
( 4)已知醇和醛可以发生反应:![]() ,聚乙烯醇
,聚乙烯醇![]() 可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
(1) 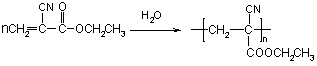 (2分)
(2分)
(2)  (2分)
(2分)
(3) ![]() 、
、![]() 、CH2=CHCH(OH)CHO
(3分,各1 分,合理则给分)
、CH2=CHCH(OH)CHO
(3分,各1 分,合理则给分)
(4) 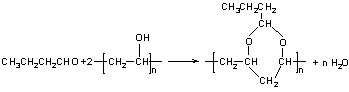 (3分)
(3分)
24、物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。反应过程中生成的水等与转化无关的物质已经略去。这些物质有以下转化关系。试回答以下问题:
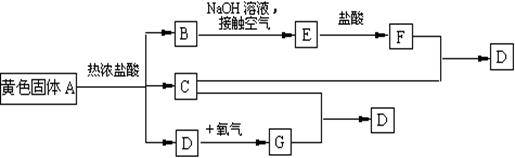
(1)A是 ,C是 ,F是 (均填化学式)。
(2)A与热盐酸反应的离子方程式为
(3)写出该框图中由B→E的化学方程式
(1)A:FeS2 C.H2S D.FeCl3
(2)FeS2+2H+=Fe2++H2S↑+S
(3)FeCl2+2NaOH=Fe(OH)2↓+2NaCl; 4Fe(OH)2+O2+2H2O=4Fe(OH)3
五、本题共一小题
25、将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式________________________________________________
____________________________________________________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
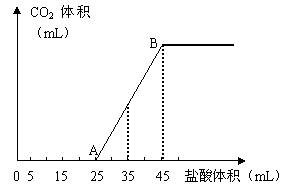 |
(1)H+ + OH— = H2O,CO32— + H+ = HCO3— (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
![]() x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
84g/mol·x + 106g/mol·y + 40g/mol·z = 2.5g
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为0.6g,Na2CO3的质量分数为![]()