高三化学上学期第二次模拟考试试题
化 学 试 卷
时间:70分钟 总分:100分 命题人:邵明昇 校对人:刘君
可能用到的数据:H:1 C:12 N:14 S:32 O:16 Cl:35.5 Cu:64
注意:将选择题的答案涂在答题卡上,交卷时只交第五、六、七页
第Ⅰ卷 选择题(共54分)
一、选择题(本题包括18个小题,每题只有一个选项符合题意,每题3分,共54分)
1.2007年9月1日,经国务院批准,国家发改委等十七个部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围。下列有关做法不符合这一要求的是 ( )
|
B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应:2CO+2NO 2CO2+N2
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在火力发电、核能发电和风力发电中,要大力发展火力发电
2.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
A.KClO3是氧化剂在反应中被氧化 B.CO2是氧化产物
C.H2SO4在反应中做氧化剂 D.1 mol KClO3 参加反应失去2 mol 电子
3.在同温同压下,相同体积的甲、乙两种气体的质量比是11:7。若乙气体是C2H4,则甲气体可能是 ( )
A.N2O B.H2S C.O2 D.HCl
4.下列离子反应方程式正确的是
A.澄清石灰水来吸收氯气:Cl2+Ca(OH)2=Cl-+ClO-+Ca2++H2O
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在少量的碳酸氢钙溶液中加入过量的苛性钾溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
5.下列有关物质结构的叙述,不正确的是 ( )
A.含有非极性键的分子不一定是非极性分子
B.氢化物的氢键与它的稳定性没有直接的关系
C.熔融状态时能导电的晶体一定是离子晶体
D.共价化合物中一定有极性键, 离子化合物中可能有非极性键
6.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为19,A与C同主族,A与B同周期。则下列叙述正确的是 ( )
A.原子半径:A<B<C B.三种元素的最高价氧化物对应水化物均显酸性
C.单质A能被单质B从化合物中置换出来 D.A的氢化物最稳定
7.室温下,下列溶液中,各离子浓度的关系不正确的是 ( )
A.浓度均为0.1mol·L-1的盐酸溶液与氨水溶液等体积混合
c(NH4+) + c(NH3·H2O ) =c(Cl-)
B.pH=8 的NaB溶液,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.Na2CO3溶液中,c(OH-)=c(HCO3-)+c(H2CO3)+ c(H+)
8.下列实验方法正确的是 ( )
A.测定溶液pH时,用玻璃棒蘸取原溶液滴在润湿的pH试纸上与比色卡比较
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.用渗析的方法精制氢氧化铁胶体
D.测定硫酸铜晶体中结晶水含量,实验过程中至少需要称量三次
9.NA代表阿伏加德罗常数,下列说法中一定正确的是 ( )
A.1 mol Cl2参加反应时,转移的电子数一定是2 NA
B.1L 0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5NA
C.常温常压下,16g 14CH4所含质子数为10NA
D.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3 NA
10.以下实验操作将导致所测结果数据偏高的是 ( )
A.进行中和热的测定实验中,将酸碱一次性混合搅拌,待半分钟后读出温度
B.用量筒量取一定体积的溶液,读数时仰视液面
C.用滤纸放在托盘天平托盘上称量NaOH固体,配制100mL 0.1mol/L溶液
D.中和滴定测量未知酸溶液的浓度,锥形瓶未用待装的酸溶液润洗
11.下列有关工业生产的叙述正确的是
( )
A.合成氨生产过程中采用高温(500℃),可提高N2、H2的转化率
B.电解精炼铜时,粗铜极得到的电子等于精铜极失去的电子
C.硫酸工业中,在吸收塔里用98.3%的硫酸可以提高SO3的吸收效率
D.利用电解饱和食盐水原理在工业上只能用于制取烧碱
12.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.143 | 0.099 | 0.089 | 0.071 |
| 主要化合价 | +1 | +3 | +7、-1 | +2 | -1 |
下列叙述不正确的是
A.在相同条件下,单质的还原性:L>R
B.L、M、Q最高价氧化物对应水化物两两间有三个反应
C.Q、T两元素的氢化物分子间都存在氢键
D.L、T形成的简单离子中L的简单离子半径小
13.室温下,由水电离得到的c(H+)和c(OH—)的乘积为1×10-24的无色溶液中,可能大量共存的离子组是
A.Na+、Fe2+、Br-、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、I-、NO3-、H+ D.K+、NO3-、SO42-、OH-
14.铜的冶炼大致可分为: ⑴富集:将硫化物矿进行浮选; ( )
⑵焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
⑶制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2=2Cu2O+2SO2; 2Cu2O+ Cu2S=6 Cu+SO2↑;
⑷电解精炼。
下列说法正确的是 ( )
A.上述灼烧过程的尾气均可直接排入空气
B.由6mol CuFeS2生成6molCu,反应共消耗15molO2
C.在反应2Cu2O+ Cu2S=6 Cu+SO2↑中,氧化剂只有Cu2O
D.在反应中2Cu2S+3O2=2Cu2O+2SO2氧化剂与还原剂的质量比是3:2
15.从教材中可知氨气分子的结构为三角锥形,而CO2为直线型,请你从最外层电子成键的特点分别推测H2S和BF3的立体结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
16.下列指定微粒的个数比为2:1的是 ( )
A.Be2+离子中的质子数和电子数 B.21H原子中的中子和质子
C.Na2CO3溶液中的Na+和CO32- D.CaC2晶体中的阴离子和阳离子
17. 常温下,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通过一段时间后,在阴极产生a mol气体,恢复到常温,同时有沉淀析出,有关叙述正确的是( )
A.电解过程中消耗的水为a mol B.该沉淀的颜色是白色的
C.阳极的氧化产物为a mol D.电解后溶液中n(Na+)不变
18.依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。下列叙述不正确的是 ( )
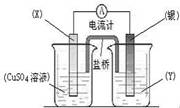 A.电极X的材料是Cu;电解质溶液Y是AgNO3;
A.电极X的材料是Cu;电解质溶液Y是AgNO3;
B.银电极为电池的正极,
C.X端发生的电极反应为Cu-2e-=Cu2+
D.外电路中的电子是从银电极流向X电极。
第Ⅱ卷 非选择题(共46分)
注意:第Ⅱ卷答案填在题中的对应的位置上,其它地方不给分
二、填空题(本题包括四个小题,共计46分)
19.(11分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、 Na+、A13+、 Ag+、 Ba2+ |
| 阴离子 | OH—、C1—、CO32—、NO3—、SO42— |
已知:
①用pH试纸检验A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)根据上述推断:B C (用化学式表示)
(2)请写出A溶液呈碱性的原因(用离子方程式表示)
。

|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
| |||
| | |||
(4)写出C与D反应的离子方程式:
20.(12分)某化学兴趣小组以含铁的废铝为原料制备氯化铝晶体,设计如下的实验方案:

请回答以下问题:
(1)写出①反应的离子方程式: 。
(2)在④的操作中应在 环境中进行操作原因是
;
(3)评价步骤②的操作中难以控制之处 ,请你提出一个合理而比较容易操作的实验方案(药品可任选)
;
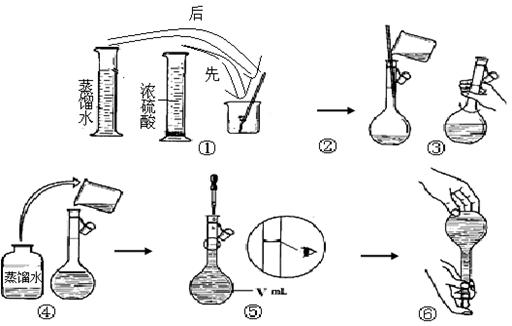
(4) 若要制取硫酸铝晶体,则②③中应加入稀硫酸。下面是该同学用浓硫酸来配制稀硫酸过程的示意图,其操作中错误的是(填操作序号) 。
21.(12分)X、Y、Z、W为短周期的四种元素,其原子序数依次增大,只有W为金属,W与X最外层电子数相同,Y、Z同周期且相邻,X、Y和Z元素原子的质子数之和比W元素原子的质子数多5。
(1) 写出Y单质的电子式是 ;
(2) W在周期表的位置是
(3)X、Y、Z、W中由三种元素组成的离子化合物的化学式是
, , (写出三种)
(4) X、Y元素可以组成分子量为32的气体M,M可以作为高能燃料,若16g M完全燃烧生成Y,放出热量为a kJ(a>0),写出M燃烧热的热化学方程式:
22.(11分)向一个体积可变的密闭容器中充入4 mol A、1 mol B,发生如下反应:
4A(g)
+ B(s) ![]() 3C(s) + 4D(g)
3C(s) + 4D(g)
在高温下达到平衡,测得混合气体中D的浓度为0.3 mol/L。请填写下列空白:
(1)若容器体积为10 L,反应经2 min达平衡,则以A物质浓度变化表示的化学反应速率为 ,达平衡时A物质的转化率为 。
(2)若压缩容器增大压强,则逆反应的速率 (填“增大”、“减小”或“不变”)。
(3)若相对分子质量M (B)>3M (C),温度升高时混合气体的平均相对分子质量减小,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6 mol/L,则容器的体积是 L。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | A | B | C | C | D | C | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | C | D | B | D | A | C | D |
19.(12分)
(1) B是Ba(OH)2 C是HCl
|
 (2)CO32-+H2O
(2)CO32-+H2O|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
((3)
|
(4)Cl-+Ag+=AgCl↓
20.(12分)
(1)2Al +2OH-+2H2O=2AlO2-+3H2↑
(2)HCl 防止氯化铝的水解
(3)使溶液的p H=8~9难以控制, 通入过量CO2气体;
|
|
|
(2)第三周期ⅠA族
(3)NaOH NH4NO3 NaNO3 NaNO2 NaNH2中的任意三种
(4)N2H4(g)+O2(g)=N2(g)+2H2O(L);△H=-2akJ/mol
22.(1)0.15 mol/(L·min) 75 % (2)增大 (3)放热 (4)5.5
