高三化学上学期10月月考试题
化 学
考生须知:
1.本卷满分100分,考试时间100分钟。
2.答题前,在答题卷密封区内填写班级和姓名、学号。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
考试时不能使用计算器。
本卷可能采用的相对原子质量:H-1,C-12,O-16, Ca-40
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.下列化学式既能表示物质的组成,又能表示物质的一个分子的是
A.NaOH B.NH4Br C.SiO2 D.CO2
2.我国汉代器物上和秦俑彩绘用的颜料“汉紫”,直到近年来人们才研究出来其成分为紫色的硅酸铜钡(铜为+2价),它的化学式为:BaCuSi2Ox,则x的值为
A.3 B.4 C.5 D.6
3.下列物质混合后产生CO2速率最快的是
A.100mL 2mol·L-1Na2CO3与100mL 2mol·L-1HCl
B.100mL 2mol·L-1NaHCO3与100mL 2mol·L-1HCl
C.400mL 1mol·L-1Na2CO3与100mL 2mol·L-1HCl
D.400mL 1mol·L-1NaHCO3与100mL 2mol·L-1HCl
4.下列物质中不属于碱性氧化物的是
A.K2O2 B.Fe2O3 C.MgO D.Na2O
5.在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2、Al2(SO4)3和Fe2(SO4)3溶液,这种试剂是
A. BaCl2 B. NH3·H2O C. AgNO3 D. NaOH
6.相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A.两者产生等量的氢气 B.强酸溶液产生较多的氢气
C.弱酸溶液产生较多的氢气 D.无法比较两者产生氢气的量
7.中学化学课本中有大量的数据材料,下面是某学生对数据的利用情况,其中不正确的是
A.利用液体密度可以判断液体物质挥发性的大小
B.利用固体溶解度数据可判断AgCl与KI溶液能否反应
C.由原子(或离子)半径数据可推断某些原子(或离子)的氧化性或还原性强弱
D.利用沸点数据可推测将一些液体混合物分离开来的可能性
8.对于下列事实的解释错误的是
①蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性
②浓硝酸的颜色变黄,说明浓硝酸见光易分解
③SO2气体通入溴水使溴水褪色,说明SO2具有漂白性
④乙醛能发生银镜反应,说明乙醛具有氧化性
A.①②③④ B.③④ C.只有③ D.只有④
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+C12(g)=2HCl(g);△H = -184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H == -802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(1);△H == -571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);△H = -283kJ/mol
10.用惰性材料作电极,分别电解下列物质,当通过相同电量时,下列指定的电极上析出气体质量最大的是
A.NaOH溶液(阴极) B.NaCl溶液(阴极)
C.熔融的NaCl(阳极) D.Na2SO4溶液(阳极)
11.下列离子方程式书写正确的是
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-=AlO2-+2H2O
B.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
C.NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH-
D.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
12.在加入铝粉能放出H2的溶液中,可能大量共存的是
A.NH4+、NO3-、CO32-、Na+ B.Na+、Ba2+、Mg2+、HCO3-
C.NO3-、K+、SO42-、Cl- D.NO3-、Na+、Fe2+、K+
13.下列比较正确的是
A.熔沸点高低:CH4 <SiH4 <GeH4<SnH4
B.离子半径大小:Cl-<Mg2+< O2-<F-
C.分散质微粒直径大小:Fe(OH)3胶体>CaCO3沉淀>NaCl溶液
D.酸性强弱:H2SO4<H3PO4<H2SiO3
14.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
15.法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。(如图所示)
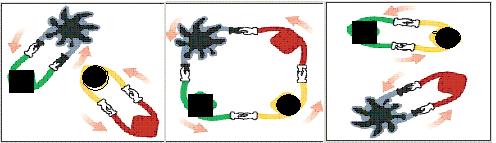
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后,两
对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。把C6H5CH2CH==CH2与CH2==M在一定条件下混合反应,下列产物不可能存在的是
A.C6H5CH2CH==M B.CH2= CH2
C.C6H5CH2==CH2C6H5 D.C6H5CH2CH==CHCH2C6H5
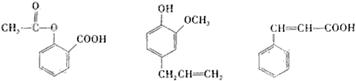 16.可用于鉴别以下三种化合物的一组试剂是
16.可用于鉴别以下三种化合物的一组试剂是
乙酰水杨酸 丁香酚 肉桂酸
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
三、(本题包括3小题,共20分)
17.(6分)周期表中前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与D、B与E原子的电子层数都相差2。A、B原子最外层电子数之比为1∶4。A和D能以原子个 数比1∶1形成化合物。
(1)写出元素符号 A___▲___;B___▲___;D___▲___E___▲___。
(2)B与D形成的化合物是___▲___分子(填极性、非极性)。
(3)用电子式表示A和D形成化合物过程___▲___。
18.(8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
![]() 反应Ⅰ HgS
+O2 Hg +SO2
反应Ⅰ HgS
+O2 Hg +SO2
![]() 反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
请试完成下列问题:
(1)HgS与氧气反应,氧化剂是___▲___。
(2)请标出反应Ⅱ中电子转移的方向和数目___▲___。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式:___▲___。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+
![]() Hg22+ ,提高Hg22+浓度的方法是:___▲___。
Hg22+ ,提高Hg22+浓度的方法是:___▲___。
19.(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是___▲___(填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是___▲___(填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是___▲___(填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 ▲ 。
四、(本题包括2小题,共12分)
20.(4分)下列有关实验说法错误的是___▲___
A.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.除去铝器皿表面的碳酸钙而不损伤铝器皿,可用冷的浓硫酸。
C.水中含有少量苯和硝基苯,可用活性碳吸附除去
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
E.检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-
 F.准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处。
F.准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处。
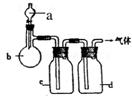
21.(8分)拟用如图装置制取表中的四种干燥、纯净的
气体(图中铁架台、铁夹、加热及气体收集装置均已
略去;必要时可以加热;a、b、c、d表示相应仪器中
加入的试剂)。
| 气体 | a | b | c | D |
| CO2 | 盐酸 | CaCO3 | 饱和Na2CO3溶液 | 浓硫酸 |
| Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
| NO | 稀HNO3 | 铜屑 | H2O | P2O5 |
(1)上述方法中可以得到干燥纯净的这种气体是___▲___
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体___▲___理由是___▲___;
②气体___▲___理由是___▲___;
③气体___▲___理由是___▲___;
④气体___▲___理由是___▲___。
五、(本题包括2小题,共16分)
22.(8分)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质。请回答下列问题:
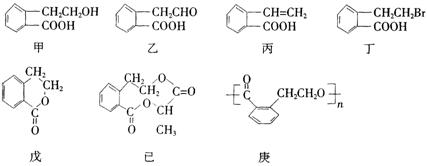
(1)指出反应的类型: 甲→丙:___▲___,甲→丁:___▲___。
(2)在甲~庚七种物质中,互为同分异构体的是___▲___(填代号,多选扣分,下同);
可看作酯类的是___▲___。
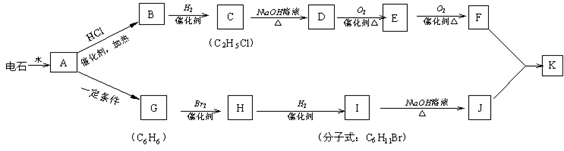 23.(8分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
23.(8分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
(1)写出实验室制取A的化学方程式:___▲___;
(2)写出D→E的化学方程式:___▲___;
(3)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:___▲___;
(4)写出酯K的结构简式:___▲___。
六、(每题包括2小题,共12分)
24.(6分) 过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
① 称取0.270克样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6毫升。
② 另取0.120克样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200摩/升KMnO4溶液滴定,共用去31.0毫升KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1)计算样品中的CaO2的质量分数。
(2)计算样品中的CaO2·xH2O的x值。
25.(6分) 通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L (在相同条件下测定)。
⑴试确定原混合气体中CO的体积V(CO)。
⑵若反应后的气体密度在相同条件下为H2的15倍,试确定混合气体中各组分的物质的量之比。
 高三化学上学期10月月考试题
高三化学上学期10月月考试题
化学答卷 成绩
一、选择题(本题包括8个小题,每小题2分,共16分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
| 得分 |
二、选择题(本题包括8个小题,每小题3分,共24分。每小题只有一个选项符合题意。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
| 得分 |
| 得分 |
三、(本题包括3小题,共20分)
17.(6分)
(1)A ,B ,D ,E ,。
(2) 。
(3) 。
18.(8分)
(1)
(2)4HgS +4CaO===4Hg +3CaS + CaSO4
(3)
(4)___
19.(6分)
(1)
(2)
(3)
(4)___
| 得分 |
四、(本题包括2小题,共12分)
20.(4分)__ ___。
21.(8分)
(1)
(2) ①气体_____ _理由是___ ___;
②气体_____ _理由是___ ___;
③气体_____ _理由是___ ___;
④气体_____ _理由是___ ___;。
| 得分 |
五、(本题包括2小题,共16分)
22.(8分)
(1)___ ______ ___,___ ______ ___;
(2) ,
23.(8分)
(1)
(2)
(3)
(4)___
| 得分 |
六、(每题包括2小题,共12分)
24.(6分)
25.(6分)
化学参考答案(2007年12月)
一、选择题(本题包括8个小题,每小题2分,共16分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | D | B | A | D | C | A | B |
二、选择题(本题包括8个小题,每小题3分,共24分。每小题只有一个选项符合题意。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | C | B | C | A | B | C | A |
三、(本题包括3小题,共20分)
17.(6分)
(1)A K B Si D F E H
(2)非极 (3)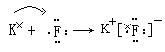 (每空1分)
(每空1分)
18.(8分)
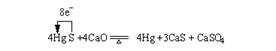 (1)HgS和O2
(1)HgS和O2
(2) (双线桥表示也可)
(3)3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ +4H2O
(4)增大Hg2+ 浓度 (每空2分)
19.(6分)
(1)④②①③⑤ (2分) (2)⑤ (1分) (3)①②(1分)
(4)HCO3-+AlO2-+H2O===Al(OH)3↓+CO32- (2分)
四、(本题包括2小题,共12分)
20.(4分)
BDEF(共4分,错选1个扣1分,少选1个扣1分,不出现负分)
21.(8分)
(1)NO(2分)
(2)①CO2、CO2通过C中的饱和Na2CO3溶液时被Na2CO3吸收生成NaHCO3(2分)
②Cl2、Cl2通过C中的NaOH溶液时被NaOH溶液吸收(2分)
③NH3、NH3通过C中的H2O时被H2O吸收(2分)
五、(本题包括2小题,共16分)
22.(8分)
(1) 消去;卤代(取代)
(2) 丙、戊;戊、己、庚。
23.(8分)
(1)CaC2 +2H2O →Ca(OH)2 + C2H2 ↑
(2)2CH3CH2OH + O2 ![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
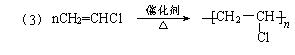
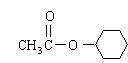
(4)
六、(每题包括2小题,共12分)
24.(6分)解:
(1)2CaO2 = 2CaO+O2
w(CaO2)=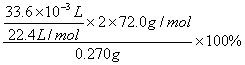
=80% (2分)
(2)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol/L×5/2=0.00155mol (1分)
其中CaO2所含的n(Ca2+)=![]() =0.00133mol
=0.00133mol
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol =0.012g(1分)
[0.12g-(0.12g×80%)-0.012g]/18g.mol-1:0.00133mol=x :1 (1分) x=0.5(1分)
25.(6分)解:
(1) 2CO + O2 === 2CO2 △V
2 1 2 1
2(m-n)L (m-n)L (m-n)L
若O2过量,则V(CO) = 2(m-n)L; (2分)
若CO2过量,则V(CO) = [m-(m-n)]L = nL。(2分)
(2) ∵ ![]() (混) = 2×15 = 30
(混) = 2×15 = 30
∴由平均值规律知,反应后的混合气体为CO和CO2。
∴由十字交叉法:
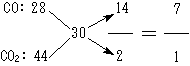
得:n(CO)∶n(CO2) = 7∶1。(2分)