高三化学上学期12月阶段检测试题
相对原子质量:H 1 C 12 O 16 Na 23 Al 27 S 32 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电
极反应式中,能表示铁的电化学腐蚀的是( )
①Fe—2e—=Fe2+ ②2H++2e—=H2↑ ③Fe—3e—=Fe3+
④2H2O+O2+4e—=4OH— ⑤4OH——4e—=2H2O+O2↑
A.①②⑤ B.②③④ C.①②④ D.①③⑤
2.在下列分散系中,分散质微粒直径最大的是
A.淀粉溶液 B.新制氢氧化铜悬浊液
C.C60 的四氯化碳溶液 D.雾
3.氯碱工业上电解饱和氯化钠溶液时,所得的氢氧化钠主要集中在
A.正极 B. 负极 C. 阳极 D. 阴极
4.美国康乃尔大学的魏考克斯(C·wilcox)所合成的一种有机分子就像一尊释迦牟尼佛,因而被称为释迦牟尼分子(所有原子在同一平面上),其结构如右图所示。有关该有机分子的下列说法中,不正确的是
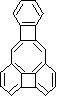 A.该有机物属于芳香烃
A.该有机物属于芳香烃
B.该有机物不属于苯的同系物
C.该有机物分子中含有22个碳原子
D.该有机物的一氯代物只有3种
5.主链含5个碳原子,有甲基、乙基2个支链的烷烃有
A.2种 B.3种 C.4种 D.5种
6.有关右图装置中的叙述正确的是
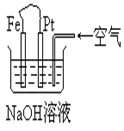 A.这是电解NaOH溶液的装置
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到 Fe(OH)2 沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
7.常温下,将pH=2的盐酸与pH=13Ba(OH)2溶液混合后,所得溶液的pH=11,则盐酸与Ba(OH)2溶液的体积比为
A.1:11 B.11:1 C.1:9 D.9:1
8.将 1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。若此时移走0.5molO2和0.5molSO2,则重新达到平衡后,SO3的物质的量为
A.0.3mol B.0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
9..要求设计实验证明,某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是
A.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸
热的
B.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
C.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混和液温度下降,说明盐类水解是吸热的
D.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸
热的
10.下列金属冶炼的反应原理,错误的是
A、2NaCl(熔融) 2Na + Cl2↑ B 、MgO + H2 Mg + H2O
C、Fe3O4 + 4CO 3Fe + 4CO2 D、2HgO 2Hg + O2↑
11.镍的氧化物和铁作电极形成的电池叫镍铁蓄电池,又称碱性电池,其放电时总反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2。关于此蓄电池的推断正确的是
A.放电时负极反应式为:2Ni(OH)2-2e- Ni2O3+2H++H2O
B.放电时正极上Ni2O3发生还原反应
C.放电一段时间后,负极周围的pH一定升高
D.每消耗1mol Fe,则电路上转移的电子为1mol
12..下列反应的离子方程式正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2==Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-==CaCO3↓+H2O
C.FeS固体放人稀硝酸溶液中:FeS+2H+==Fe2++H2S↑
D.AlCl3溶液中加入过量氨水:Al3++4OH-==AlO2-+2H2O
![]() 13..在4L密闭容器(体积不变)中充入6molA气体和5molB气体,在一定条件下发生反应3A(g)+B(g) 2C(g)+xD(g), 达到平衡时,生成了2molC,经测定D的浓度为0.5mol·L-1,下列判断中正确的是
13..在4L密闭容器(体积不变)中充入6molA气体和5molB气体,在一定条件下发生反应3A(g)+B(g) 2C(g)+xD(g), 达到平衡时,生成了2molC,经测定D的浓度为0.5mol·L-1,下列判断中正确的是
A.X=1
B.B的转化率为20%
C.平衡时A的浓度为1.5mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
14.有4种有机物:①![]() ②
②![]() ③
③![]() ④CH3-CH=CH-CN,其中可用于合成下列结构简式的高分子材料的正确组合为
④CH3-CH=CH-CN,其中可用于合成下列结构简式的高分子材料的正确组合为
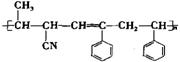
A.①③④ B.①②③ C. ②③④ D. ①②④
![]() 15.下列关于
的说法正确的是
15.下列关于
的说法正确的是
A.所有碳原子有可能都在同一平面上
B.最多只可能有9个碳原子的同一平面上
C.有7个碳原子可能在同一直线上
D.只可能有6个碳原子在同一直线上
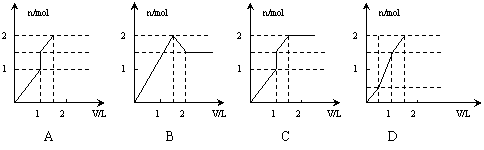 |
16.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
高三化学上学期12月阶段检测试题
高 三 化 学 答 题 卡
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题,共52分)
二. 填空题(本题共有4个小题;共34分)
17.(8分)25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。
(1)若所得溶液的pH=11,且a=13,b=2,则Va︰Vb= 。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4(填“可”或“否”)
,其理由是 。
(3) 为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为 AG=lg。25℃时,若溶液呈中性,则AG= ,溶液的pH与AG的换算公式为AG= (要简化)。
18.(10分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·![]() 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____ ___________,产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是_________________________________
_________________________________________________________。
(3)③中所发生的各反应的离子方程式是_____________________________ ______________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为___________________,
c(Fe2+)为____________________________________________________。
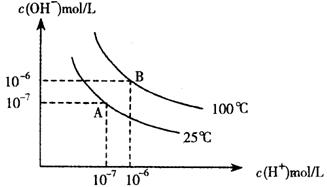
19.(8分)在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示:
|
(1)A点水的离子积为1×10-14,B点水的离子积为 。造成水的离子积变化的原因是 。
![]() (2)25℃时,H2R在水溶液中的电离方程为:H2R=H++HR-,HR-
H++R2-。
(2)25℃时,H2R在水溶液中的电离方程为:H2R=H++HR-,HR-
H++R2-。
①0.1mol/LH2R溶液的pH 1(填“>”、“<”或“=”);
②在0.1mol/LNaHR溶液(呈酸性)中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01mol/LNaOH溶液的pH= 。
20.(8分) 2005年度诺贝尔化学奖授予法国和美国的三位科学家,以表彰他们在烯烃复分解反应研究领域作出的卓越贡献。
烯烃复分解反应如下例(炔烃也可发生类似反应)
CH2=CH—CH3 + CH2=CH—CH3 ![]() CH2=CH2
+ CH3CH=CHCH3
CH2=CH2
+ CH3CH=CHCH3
反应中,双键断裂后的部分重新两两结合。
CH2=CHCH2CH2CH2CH2CH= CH2的名称是1,7-辛二烯。
(1)以下物质中与1,7-辛二烯互为同分异构体的是__________(填序号)。
a.![]() b.
b.![]() c.
c.![]()
(2)1,7-辛二烯的不具备的性质是______________(填序号)。
a.能溶于水 b.能使溴水褪色
c.能使酸性高锰酸钾溶液褪色 d.能发生加成反应
(3)写出CH3C≡CH和CH≡CCH3发生炔烃复分解反应的化学方程式
_____________________________________________________。
(4)1,7-辛二烯发生烯烃复分解反应不可能生成的物质是_________ (填序号)。
a.CH2=CH2
b.![]()
c.![]() d.
d.![]()
三、实验题(本题共有1个小题;共12分)
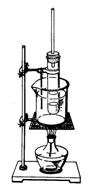 21(12分)实验室制硝基苯的装置如图所示:
21(12分)实验室制硝基苯的装置如图所示:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应容器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃发生反应,直到反应结束。除去混合酸后得到粗硝基苯。
④依次用蒸馏水和5%的氢氧化钠溶液洗涤,最后再用蒸馏水洗涤。
⑤将无水氯化钙干燥后的粗硝基苯蒸馏,得到硝基苯。
(1)制硝基苯的化学方程式为_________________________。纯硝基苯是无色,密度比水______(选填“大”或“小”),具有________气味的油状液体。
(2)配制一定比例的浓硫酸与浓硝酸的混合酸,混合的顺序是______________________。
 (3)步骤③中,为了使反应在60℃下进行,常用的加热方法如上图,该方法叫_________。在步骤④中,分离出粗硝基苯使用的一种主要仪器是________。
(3)步骤③中,为了使反应在60℃下进行,常用的加热方法如上图,该方法叫_________。在步骤④中,分离出粗硝基苯使用的一种主要仪器是________。
(4)在步骤④中,粗产品用5%NaOH溶液洗涤的目的是_______________。
(5)在上图装置中,胶塞上的长导管(约30cm)的作用是____________________。
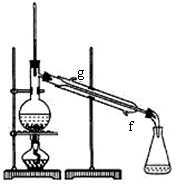
(6)将用无水CaCl2干燥后的粗硝基苯蒸馏,可用右图装置
①蒸馏时,冷却水从_______(填“g”或“f”)口进入。
②以下物质的分离提纯宜用蒸馏方法的是(括号内为杂质) __________(填序号)。
a.水(氯化钠) b.乙醇(水) c.硝酸钾(氯化钠)
四、计算题(本题共有1个小题;共6分)
![]() 22(6分)将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g) 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。甲是恒压容器,乙是恒容容器。甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态。请回答:
22(6分)将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g) 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。甲是恒压容器,乙是恒容容器。甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态。请回答:
|
其所需时间 50s(填“大于”、“小于”
或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2物质
的量相等,可采取的措施是 (填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
高三化学上学期12月阶段检测试题
高三化学参考答案
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | D | D | A | C | D | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | B | B | B | B | C | A | D |
二. 填空题(本题共有4个小题;共34分)
17.(8分)(1)1︰9(1分)
(2)可(1分),若b=4, cb(H+)=10—4 mol·L—1,a=8 ,ca(OH—)=10—6 mol·L—1;
中和时应该有Va×ca(OH—)=Vb×cb(H+),即= Vb×cb(H+)/ Va×ca(OH—)
=10—4/10—6 =100︰1,与题设Va>Vb相符合。(3分)
(3)0(1分),2(7—pH)或者14—2pH(2分)
18. (10分)(1)加少量KClO3,插上Mg条并将其点燃 Fe
(2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O
(3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+
(4)c(Mg2+)=
0.67mol·![]() , c(Fe2+)==
2.3mol·
, c(Fe2+)==
2.3mol·![]() 。
。
19. (8分)
(1)1×10-12;(1分)
水的电离是吸热过程,升高温度有利于水的电离平衡向右移动,使水的离子积增大。(2分)
(2)①pH<1;(1分)②c(Na+)>c(HR-)>c(H+)>c(R2-)>c(OH-)。(2分)
(3)pH=10。(2分)
20.(8分)(1)a,b (2分) (2)a (2分)
(3) CH3C≡CH + CH≡CCH3 → 2 CH3C≡C CH3+HC≡CH(2分)
(4)d(2分)
三、实验题(本题共有1个小题;共12分)
![]() 21(12分)
21(12分)
(1) (1分)
大,苦杏仁(各1分,共2分)
(2)将浓硝酸注入容器中,再慢慢加入浓硫酸。(1分)
(3)水浴加热(1分) 分液漏斗(1分)
(4)除去粗产品中的残余酸(1分)
(5)使反应物冷凝回流(1分)
(6)①f; ②a,b(各1分,共3分)
四、计算题(本题共有1个小题;共6分)
22,(6分)
(1)90%; 小于
(2)AC