高三化学上学期九月考试试题
(110分 90分钟完成)
注意:请将1——21题答案填入答题卷。
可能用到的相对原子质量:H—1 He—4 C—12 N—14
O—16 Na—23 Mg—24 Si—28
S—32 Cl—35.5 Ba—137
第Ⅰ卷 (选择题 共42分)
每小题只有一个选项符合题意(3分×14=42分)
1. 在三个密闭容器中分别充入He、N2、O2三种气体,当它们的温度和密度都相同时,这三种气
体的压强(p)从大到小的顺序是
A.p(N2)>p(He)>p(O2) B.p(O2)>p(N2)>p(He)
C.p(He)>p(O2)>p(N2) D.p(He)>p(N2)>p(O2)
2. 下列说法中正确的是
A.34S原子核内的中子数为16
B.16O2和18O2互为同位素
C.1H216O在相同条件下比1H218O更易蒸发
D.2H+的酸性比1H+的酸性更强
3. NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LCCl4中含有氯原子数目为4NA
B.14gCnH2n中含有的氢原子数目为2NA
C.4.5g SiO2晶体中含有的硅氧键数目为0.15 NA
D.0.5 mol·L-1Na2CO3 溶液中含有的CO32-数目小于0.5NA
4. 下列有关晶体的说法错误的是
A.碘晶体升华时,化学键没有被破坏
B.晶体中分子间的作用力越大,分子越稳定
C.金刚石和足球烯(C60)都是碳元素的同素异形体,前者是原子晶体,后者是分子晶体
D.硫酸铜晶体里结晶水含量测定的实验中,至少要进行四次称量操作
5. 下列说法正确的是:
A.位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
B.第ⅤA族元素,由上到下,对应单质的熔点逐渐升高
C.氢键不是化学键,可以把它看作一种比较强的分子间作用力
D.离子晶体溶于水或熔化时,化学键都被破坏
6. 下列各组离子在指定溶液中,能大量共存的是:
A.PH=13的溶液中:Na+,AlO2—,S2—,SO32—
B.PH=1的溶液中:Cl—,NO3—,NH4+,S2O32—
C.加入Al能放出H2的溶液中:Cu2+,NO3—,K+,SO42—
D.水电离产生的c(H+)为1×10-14mol·L-1的溶液中:Cl—,K+,NO3—,HCO3—
7. 甲、乙、丙是三种不含相同离子的可溶性离子化合物。它们的阳离子是NH4+、Na+、Mg2+,阴
离子是NO3—、SO42—、OH—。取等质量的三种化合物配制相同体积的溶液,其物质的量浓度由大
到小的顺序是甲>乙>丙。则乙物质可能是
A.MgSO4 B.NaOH
C.Mg(NO3)2 D.NH4NO3
8. 某温度下,反应2A(g)![]() B(g);△H<0,在密闭容器中达到平衡后:c(A)/c(B)=a;若改变某一条件,反应再次达到平衡,此时c(A)/c(B)=b。则下列叙述正确的是
B(g);△H<0,在密闭容器中达到平衡后:c(A)/c(B)=a;若改变某一条件,反应再次达到平衡,此时c(A)/c(B)=b。则下列叙述正确的是
A.在该温度下,若保持容积固定不变,向容器内补充B气体,则有a>b
B.若保持温度,压强不变,充人惰性气体,则有a=b
C.若其他条件不变,升高温度,则有a>b
D.若a=b,则容器中一定使用了催化剂
9. 下列说法正确的是:
A.离子方程式“H++OH-=H2O”仅能表示强酸和强碱生成可溶性盐和水的反应
B.燃料充分燃烧的条件之一是充入尽可能多的空气
C.锅炉燃煤采用沸腾炉可以增大煤炭的燃烧热
 D.稀硫酸和稀NaOH溶液反应的中和热为57.3kJ·mol-1
D.稀硫酸和稀NaOH溶液反应的中和热为57.3kJ·mol-1
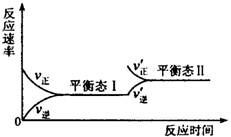
10. 右图是在恒温密闭容器中进行的某化学反应的
反应速率随时间变化的示意图。下列叙述与示意图
相符的是
A.该反应达到平衡态I后,增大反应物的浓度,同时减少生成物浓度,平衡发生移动,达到平衡态II
B.该反应达到平衡态I后,增大反应物的浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I以后,升高温度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度相等
11. 下列反应的离子方程式正确的是:
A.碳酸氢钠溶液与足量氢氧化钡溶液混合:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+ CO32-
B.向FeI2溶液中通入一定量的氯气,溶液中的Fe2+有一半被氧化
2Fe2++ 8I--+5C12 ==2Fe3++4I2+ 10C1--
C.醋酸钾的水解反应:CH3COO—+H3O+=CH3COOH+ H2O
D.以石墨作电极电解氯化镁溶液:2Cl-+2H2O
![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
12. 质量分数不同的两种氨水,以相同质量混合时,所得混合溶液密度为ρ1;以相同体积混合时,
所得混合溶液密度为ρ2。则ρ1、ρ2之间大小关系正确的是:
A.ρ1>ρ2 B.ρ1=ρ2
C.ρ2>ρ1 D.不能确定
13. N2H4在一定条件下发生分解,产生M、N2和H2,后两者的物质的量之比为3:2,下列叙述
中正确的是
A.M的化学式为NO
B.M的化学式为HN3(叠氮酸)
C.该反应中氧化产物与还原产物的物质的量之比为3:8
D.7molN2H4分解时转移的电子的物质的量为12mol
14. 足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与
3.2g O2混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入2mol·L-1NaOH
溶液至Cu2+恰好完全沉淀,则消耗溶液中NaOH的体积是
A.200mL B.400mL
C.600mL D.无法计算
第Ⅱ卷 (非选择题 共68分)
15.(8分) 实验室需要配制480mL0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)在用托盘天平称取NaOH固体时,天平读数为 。
A.2.0g B.2.00g C.>2.0g
(2)实验所需要的仪器有:托盘天平、量筒、烧杯、______________、_________、______________。
(3)下列操作会导致溶液浓度偏高的是__________(填代号)。
A.在烧杯中溶解时,有少量液体溅出
B.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度
C.容量瓶使用前未干燥
D.定容时俯视容量瓶刻度线
16.(9分)
(1)已知:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60 H2SO4,回答下列问题:
①当反应中转移120mole-时,有______molP4被还原;
②3molP4可以还原______molP4。
(2)氨气跟氯气可迅速反应生成氯化氢和氮气。当转移的电子总数为a时,生成的氮气的物质的量为bmol。 则阿伏加德罗数常数为(用含a、b的代数式表示) ______________。
17.(10分)
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现在每次取100.00ml进行实验。
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。
(3)第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。
试回答有关问题:
①判断Na+、Cl-是否存在?Na+ Cl- (填下列序号)
A.一定存在 B.可能存在 C.一定不存在
②肯定存在的离子在原溶液中的物质的量浓度分别为:______________________________
_____________________________________________________。
18.(9分)
A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Ag+ |
| 阴离子 | OH- NO3- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀和气体,沉淀可溶于E溶液;
②A溶液与C溶液反应生成沉淀,沉淀可溶于稀硝酸;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是(写化学式)
A__________________;B_________________;C_____________________。
19.(13分) A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,
其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之
和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有
三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式
为 ,Y属于 (填“极性”、“非极性”) 分子 。
(2)23gD的单质与足量Y反应放出akJ热量,写出该反应的热化学方程式
________________________________________________________________________________。
(3) 密闭容器中,1mol A2 与1mol B2一定条件下化合成BA3,反应达平衡时,B2的体积分数
_______ 50% (填“大于”、“等于”或“小于”)。工业上完成该转化一般采用的压强是20MPa~50MPa,其理由是___________________________________________________________________________
______________________________________________________________________________________________________________________________________________________。
(4) E是非金属元素,但能表现一些金属元素的性质,则E在元素周期表中的位置是_______
______________________________。
20. (11分) 下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 0.04 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | -1 | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写元素编号)。
(2)上述⑤、⑥、⑦三种元素中的两种形成的分子中,每个原子都满足最外层为8电子稳定结构的分子是(写化学式)_________________。
(3)③、⑤、⑨形成的10电子氢化物中,⑤、⑨的氢化物沸点较低的是(写化学式)__________;③、⑨的氢化物分子结合H+能力较强的是(写化学式)___________,用一个离子方程式加以证明__________________________________________________________。
(4)选择上述10种元素中的几种,写出含18个电子、分别满足下列条件的分子(写化学式,每种情况写出一种即可):
a.含有4个原子的分子:____________;
b.由两种元素组成的八原子分子:_________;
c.由三种元素组成的分子:___________。
21.(8分) 向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相
同条件下,发生下列反应:A(g)+B(g)![]() xC(g);△H<0。测得两容器中c(A)随时间t的变化如
xC(g);△H<0。测得两容器中c(A)随时间t的变化如
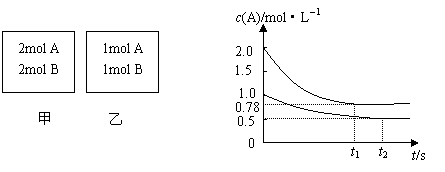 图所示:(t1、t2时刻分别达到平衡)
图所示:(t1、t2时刻分别达到平衡)
回答下列问题:
(1)当t2=50时,以A的浓度变化表示的反应的速率为________________________。
(2)若χ的值能确定,则χ=① ;
若χ不能确定,则理由是:② 。
(3)若向平衡后的乙容器中充入氦气,则c(A)___________(“增大”、“不变”或“减小”)。
(4)为了使乙容器内各物质的体积分数与甲容器内的相同,可以对乙容器进行_____________(“升温”或“降温”)操作。
(5)若向甲容器中再充入2molA、2molB,则平衡时甲容器中c(A)的取值范围是__________________
_______________。
高三九月考试化学试题 参考答案
单选题(3分×14=42分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | D | C | B | B | C | A | D | A | D | B | B | C | D | A |
非选择题(共68分)
15.(8分)
(1)C(2分) (2)500mL容量瓶、玻璃棒、胶头滴管。(3分) (3)D(3分)
16.(9分)
(1)①5 (3分)
② 5
(3分) (2)![]() (3分,不写单位得2分)
(3分,不写单位得2分)
17. (10分)
①A(1分) B(1分)
②c(Na+)≥0.2 mol·L-1 (2分) c(SO42-)=0.1 mol·L-1(2分)
c(CO32-)=0.2 mol·L-1(2分) c(NH4+)=0.4 mol·L-1(2分)
18.(9分)
Na2CO3(3分)、 Al2(SO4)3(3分)、 AgNO3(3分)。
![]() 19.(13分)
19.(13分)
⑴ (2分) 极性(1分)。
⑵2Na(s)+2H2O(l) =2NaOH(aq)+H2(g);△H=-2akJ·mol-1 (3分)
⑶等于(2分)
① 有利于增大反应速率;
② 增大压强能使化学平衡向正反应方向移动,有利于氨的合成;
③ 压强越大所需动力越大,对材料的强度和设备的制造要求也越高,会大大增加生产的投资,降低综合经济效益。(3分)
⑷第三周期第ⅣA族(2分)
20.(11分)
(1)②(1分)
(2)PCl3(1分)、CCl4(1分)
(3)CH4(1分);NH3(1分);NH3 + H3O+==NH![]() + H2O(3分)
+ H2O(3分)
(4) a. H2O2(1分)或PH3或NH2F;
b. C2H6(1分);
c. CH4O(1分)或CH3F或NH2F。
21.(8分)
(1)0.01mol·L-1·s-1(2分)
(2)①1(2分) (3)不变(1分) (4)降温(1分)
(5) 0.78mol·L-1<c(A)<1.56mol·L-1(2分)