![]()

![]()

高三化学上学期周周练练习题(三) 座位号
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cl:35.5 Br:80 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108
第Ⅰ卷(选择题 共54分)
一、选择题(本题包括18小题,每小题只有一个选项符合题意 每小题3分,共54分,)
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
2.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异构体
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为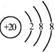 ,NH4Cl的电子式为
,NH4Cl的电子式为![]()
3.阿伏加德罗常数约为6.02×1023 mol-1,下列说法不正确的是
A.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
B.6.2g白磷P4中所含的P-P键的个数为0.3 NA
C.在标准状况下,V L CH2O中含有的氧原子个数为![]()
D.1L 0.5 mol/L CH3COONa溶液中含有的CH3COO-个数为0.5 NA
4.用右图表示的一些物质或概念间的从属关系中不正确的是
| X | Y |
| |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
 5.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
5.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
则符合上述条件的酯的结构可有
A.2种 B.4种 C.6种 D.8种
6.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
7.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Ca2+、AlO2—、SO42-、Cl- B.K+、ClO-、Cl-、NO3-
C.Na+、K+、NO3- SO42- D. NH4+、Na+、F-、CO32-
8. 下列离子方程式正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D.向NaHCO3 溶液中加过量Ca(OH)2 溶液2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-
9.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:
2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A.若增大压强,则物质Y的转化率减小
B.将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C.以X浓度变化表示的反应速率为0.001mol/(L·S)
D.若升高温度,X的体积分数增大,则该反应的△H>0
10.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应 D.第④步电解时阴极产生氯气
11.在解释物质性质变化规律与物质结构间的因果关系时,与键能无关的变化规律是
A.F2、Cl2、Br2、I2的沸点逐渐升高 B.HF、HCl、HBr、HI水溶液的酸性依次增强
C.HF、HCl、HBr、HI热稳定性依次减弱 D.与硅相比,金刚石的,熔点高
12.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加石蕊试液后显红色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
C.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS-
13.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………①
Sb4O6+6C=4Sb+6CO ……………② 关于反应①、反应②的说法正确的是:
A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6 B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
14.如右图所示,化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述正确的是
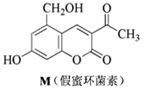 A.M既能与FeCl3发生反应,不能与CH3COOH发生反应
A.M既能与FeCl3发生反应,不能与CH3COOH发生反应
B.M与Br2只能发生取代反应,不能发生加成反应
C.M可溶于NaOH稀溶液,1molM最多消耗3mol NaOH
D.1molM在催化剂作用下最多能与4molH2发生加成反应
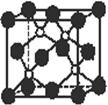 15.磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复 结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确 的是
15.磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复 结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确 的是
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4根共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
16.如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下 实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
A.断开K2,闭合K1一段时间,溶液的pH要变大
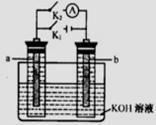 B.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-=== H2↑
B.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-=== H2↑
C.断开K2,闭合K1时,a极上的电极反应式为:4OH-―4e-=== O2↑十2H2O
D.断开K1,闭合K2时,OH-向b极移动
17.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0. 1mol/L的盐酸的pH=b,则a<b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
18.现有100 mL 溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是
A.25mL B.5mL C.30mL D.100mL
第Ⅱ卷(非选择题 共54分)
二、填空题(本题包括两小题 共23分)
19.(13分)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外电子数之和为17.请填空:
⑴Y、Z和W是否位于同一周期(填“是”或“否”): 理由是
⑵Y是 Z是 W是
⑶X、Y、Z和W可组成一化合物,其原子个数比为8:2:4:1,写出该化合物的名称及化学式:
20.(10分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
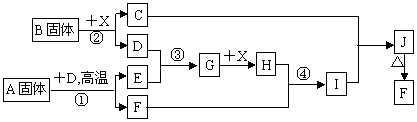 |
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
三、实验题(共12分) 21.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
![]() 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
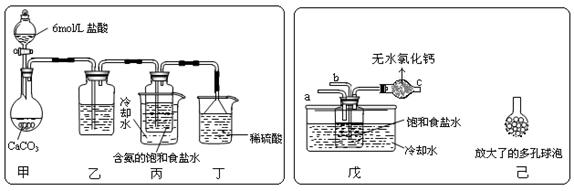
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;(Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅰ)乙装置中的试剂是 ;(Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
四、有机推断题(共19分)
22.(19分)奶油中有一种只含C、H、O的化合物A 。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
⑴. A的分子式为___________。
⑵. 写出与A分子式相同的所有酯的结构简式: ___________________________________。
已知: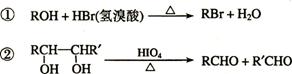
A中含有碳氧双键,与A相关的反应如下:
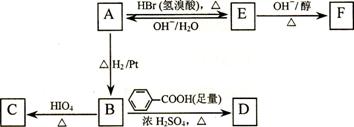
⑶.写出A → E、E → F的反应类型:A → E ___________、E → F ___________。
⑷.写出A、C、F的结构简式:A _____________、C ____________、F ___________。
⑸.写出B → D反应的化学方程式:_________________________________________。
⑹.在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________。A → G的反应类型为_________。
化学答题卷
一、选择题(本题包括10小题,每小题5分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | D | C | B | A | B | C | C | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | A | C | B | C | C | B | B | C |
二、填空题(本题包括两小题 共23分)
19.(13分)
⑴Y、Z和W是否位于同一周期(填“是”或“否”): 否 理由是 若位于同一周期则Y、 Z、W的最外层电子数职和不可能为17。
⑵Y是 氮 Z是 氧 W是 硫
⑶X、Y、Z和W可组成一化合物,其原子个数比为8:2:4:1,写出该化合物的名称及化学式:
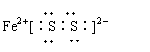 硫酸铵 (NH4)2SO4
硫酸铵 (NH4)2SO4
20.(1)G的化学式为 SO3 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方2Na2O2+2H2O=4Na++4OH-+O2↑
(4)反应④的离子方程式: Fe2O3+6H+=2Fe3++3H2O ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
4FeS2(S)+11O2(g)=2Fe2O3(S)+8SO2(g);△H=-3408 kJ·mol-1
21.(12分) (1)c (1分)(2)①(Ⅰ)饱和碳酸氢钠溶液; (Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分));(Ⅲ)过滤 (每空1分,共3分)②(Ⅰ)a、NH3, b、CO2; (每空1分,共4分)(2)增大气体与溶液接触面积,提高CO2吸收率; (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
22. ⑴A的分子式为_C4H8O2__________。
⑵写出与A分子式相同的所有酯的结构简式: HCOOCH2CH2CH3; HCOOCH(CH3)CH3; CH3COOCH2CH3; CH3CH2COOCH3
⑶.写出A → E、E → F的反应类型:A → E __取代反应_________、E → F _消去反应__________。
⑷.写出A、C、F的结构简式: 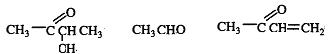
⑸.写出B → D反应的化学方程式:
CH3CH(OH)
CH(OH)CH3+2C6H5COOH![]() CH3CH(OOCC6H5)
CH(OOCC6H5)CH3+2H2O
CH3CH(OOCC6H5)
CH(OOCC6H5)CH3+2H2O
⑹.在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:CH3COCOCH3 A → G的反应类型为__氧化反应_______。
 Z
Z