高三化学上学期月考测试试题
注意事项:
1、本试卷分第I卷(选择题,1—4页)和第Ⅱ卷(非选择题,5—10页)两部分。
2、考试时间100分钟,满分100分。
3、考生务必将第I卷的正确答案用2B铅笔涂写在答题卡上。
4、可能用到的相对原子质量:H:1 C:12 O:16 Na:23 S:32 K:39 Cu:64 Ba:137
第I卷(选择题 共42分)
一、(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
1.在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式……主要污染物排放得到有效控制。”下列做法符合该指导思想的是
A.大量使用合成洗涤剂洗涤衣物
B.大量使用尿素替代碳酸氢铵以提高农作物产量
C.大量使用一次性竹、木筷子以推动林业发展
D.大量利用垃圾生产燃料、肥料,“变废为宝”
2.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3 ②Fe2O3 ③Cu(NO3)2
④KNO3 铜粉溶解的是
A.只有① B.只有②
C.只有③ D.上述四种物质中任意一种
3.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.将2molNO和1molO2混合后,体系中的原子总数为6NA
B.0.01molMg在CO2中完全燃烧,转移电子数为0.01NA
C.标准状况下,3.2gCu与足量的浓硝酸反应生成气体的分子数为0.2NA
D.7.8gNa2O2含有的阴离子数为0.2NA
4.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.KI溶液(淀粉溶液) B.FeCl2溶液(KSCN溶液)
C.Na2SO3溶液(BaCl2溶液) D.NaOH溶液(盐酸)
5.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+4OH-=[Al(OH)4]-+H2↑
B.把钠块投入到硫酸铜溶液中:2Na++Cu2+=2Na++Cu
C.三氯化铁溶液跟氨水混合:Fe3++3NH3·H2O=Fe(OH)3 ↓+3NH4+
D.过量的硫酸氢钠与氢氧化钡溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
6.下列说法不正确的是
A.pH=3的醋酸与pH=11的NaOH溶液等体积混合后,溶液的pH一定小于7
B.pH<7的溶液一定是酸溶液
C.离子化合物中可能存在共价键
D.pH=14的溶液中,Na+、CO32- 、K+、CIO—可以大量共存
7.一定温度下,在2L的密闭容器中加入4 mol A和6 mol B,发生如下反应:2A(g)+3B(g)![]() 4C(g)+D(g),反应10 min后达到平衡,此时D的浓度是0.5 mol·L-1。下列说法正确的是
4C(g)+D(g),反应10 min后达到平衡,此时D的浓度是0.5 mol·L-1。下列说法正确的是
A.反应达平衡时c(B)=1.5 mol·L-1
B.前10 min内反应的平均速率v(C)=0.1 mol·(L·min)-1
C.恒温下,将压强变为原来的2倍,则再次达平衡时D的浓度小于1 mol·L-1
D.10 min后向容器中加入A,再次达平衡时,A的转化率一定大于50%
8.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
| ||
| X |
|
|
|
| Y | Z |
|
|
|
|
| W |
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①② C.①②③ D.①②③④
9.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是
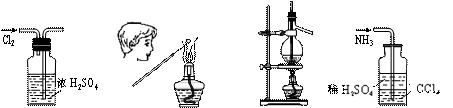
A.干燥Cl2 B.检验K2CO3中的K+ C.石油的蒸馏 D.吸收NH3
10.下列叙述中正确的是
A.中和滴定时,左手控制滴定管活塞,右手旋摇锥形瓶,眼睛注视滴定管中液面
B.用干燥的pH试纸检测某溶液的酸碱性
C.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
D.向滴有酚酞的NaOH溶液中通入Cl2,红色消失,说明HClO具有漂白性
11.下列说法中,正确的是
A.Kw随温度、浓度的改变而改变
B.凡是能自发进行的化学反应,一定是△H<0、△S>0
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
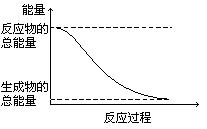 12.下列变化为放热反应的是
12.下列变化为放热反应的是
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如右图所示的化学反应
13. 根据相关化学原理,下列判断正确的是
A.若X的质子数为a,中子数为b,则X的质量数为:a - b
B.若A2+2D- 2A-+D2,则氧化性:D2>A2
C.若R2- 和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
14.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)
化 学
第Ⅱ卷 (非选择题,共58分)
注意事项:
1.第Ⅱ卷共6页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
二、(本题包括2小题,共18分)
15、(7分)(1)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯 F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);
②使用时必须检查是否漏水的有 (填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有 (填序号);
(2)下列有关实验操作说法中,正确的有 (填序号);
①用pH试纸测得氯水的pH为2
②除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,过滤
③仅用蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
④分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑤用碱式滴定管量取25.00mL溴水
⑥用瓷坩埚灼烧各种钠的化合物
⑦在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体
⑧实验中多取的试剂都不得放回原试剂瓶
(3)现用物质的量的浓度为a mol / L的标准盐酸去测定未知物质的量浓度的NaOH溶液V mL,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;
②下图是酸式滴定管中液面在滴定前后的读数:
 |  |
c(NaOH)= ;
③若在滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
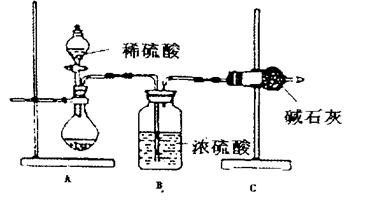
16、(11分)一般测定样品中成分含量的实验应重复2—3次。为了测定某氢氧化钠固
体中混有的碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:
|
Ⅰ.甲同学的方案如上图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进
行 次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能的原因是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收;
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收;
D.加入稀硫酸的量不足
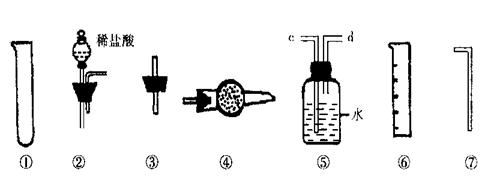
Ⅱ.乙同学的方案是:从下图所提供的装置中选择实验装置,代替甲同学实验的
B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
(1)选择最简装置的连接顺序为 ;
|
Ⅲ.丙同学的方案是:称取样品mg,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ;
(2)Ca2+、Ba2+都可以使CO32-沉淀完全。乙同学能否使用氯化钙溶液代替氯化钡溶液? 原因是
。
| 得分 | 评卷人 |
|
|
|
三、(本题包括1小题,共12分)
17、(12分)X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子层数的2倍,Z元素是植物生长的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素:X ,Y ,Z (写元素符号)。
(2)Y元素的单质中有一种称为足球烯的分子Y60,它可能最易发生的反应是 。
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)最近科学家们合成了由Z元素形成的Z5n+,电子式为![]() 则n值为 。
则n值为 。
(4)Z与X可形成多种化合物,其中ZX3的结构式 ,Z2X4的电子式 。(用判断出的X,Y,Z的元素符号表示)
(5)Z的最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。
①甲的浓溶液与Y元素的单质共热的化学反应方程式为 。
②丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(用离子方程式表示)
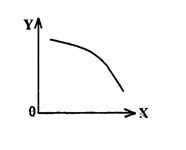 ③在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达
③在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达
到平衡状态后,改变其中一个条件X,Y随X的变化符合图
中曲线的是 (选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示乙的物质的量时,Y表示某一生成物的物质的量
c.当X表示反应时间时,Y表示混合气体
|
| 得分 | 评卷人 |
|
|
|
(6)若X的单质的燃烧热为M kJ·mol-1,试写出其单质在空气中燃烧的热化学方程式:
。
四、(本题包括2小题,共18分)
18、(4分)有甲、乙两份等体积的浓度均为![]() 的氨水,pH为11.
的氨水,pH为11.
(1)甲用蒸馏水稀释100倍,则![]() 的电离平衡将向________(填“促进”或“抑
的电离平衡将向________(填“促进”或“抑
制”)电离的方向移动,溶液的pH将为________(填序号).
A.9~11之间 B.11 C.12~13之间 D.13
(2)乙用![]() 的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH_________(填“甲大”、“乙大”、“相等”),其原因是_______________________
的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH_________(填“甲大”、“乙大”、“相等”),其原因是_______________________
______________ 。
19、(14分)在一定条件下,工业合成氨的反应如下:
![]() N2(g)+3H2(g) 2NH3(g)
请回答下列问题:
N2(g)+3H2(g) 2NH3(g)
请回答下列问题:
⑴已知:N2(g)+O2(g)=2NO(g) DH1=180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) DH2=-905 kJ·mol-1
2HHGG2(g)+O2(g)=2H2O(g) DH3=-483.6 kJ·mol-1
![]() 则反应N2(g)+3H2(g) 2NH3(g)的DH=
。
则反应N2(g)+3H2(g) 2NH3(g)的DH=
。
⑵在一定温度下,将1.5 mol N2和6 mol H2通入体积为1 L的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则平衡混合气中NH3的体积分数为 。若改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 (选填顺序编号)。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会产生白烟(成份为氯化铵),写出该反应的化学方程式 。
(4)①某化工厂生产的氨水的物质的量浓度为20 mol·L-1,实验室若需用80 mL浓度为5 mol·L-1的氨水时,需量取20 mol·L-1的氨水 mL;配制该溶液时,除用到100 mL容量瓶外,还需要的玻璃仪器有
。
②常温下,设该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH
(14—a)(填“大于”“小于”或“等于”)。
| 得分 | 评卷人 |
|
|
|
五、(本题包括1小题,共10分)
20、(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:
K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,回答下列问题:
(1)一定不存在的离子是 ,不能确定是否存在的离子是 ;
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号 ,浓度
离子符号 ,浓度
离子符号 ,浓度
(3)试确定K+是否存在 (填“是”或“否”),判断的理由是
。
化学参考答案及评分标准
第I卷(选择题, 每小题3分, 共42分)
1.D 2.D 3.A 4.C 5.C 6.B 7.A 8.C 9.D 10.B 11.D 12.D 13.D 14.D
第Ⅱ卷 (非选择题,共58分)
15.(每空1分,共7分)
(1) ① C ,② A C G ,③ B E (2) ③④ (以上各空错一全错)
(3)①用标准盐酸溶液润湿2——3次 ② a(V2–V1)/V mol/l
③ 偏高
16、(共11分)
Ⅰ.(1)4(1分) (2)ABCD(2分,缺一种扣1分,扣完为止)
Ⅱ.(1)⑤⑦⑥(2分) (2)d(1分)
Ⅲ.(1)![]() (2分)
(2分)
(2)不能,(1分)因为过量的Ca2+可能与OH-生成微溶于水的Ca(OH)2沉淀而影响测定结果(2分)
17、(每空1分,共12分)
(1)H C N(每个1分,共3分) (2)C (1分) (3)1(1分)
![]()
(5)①C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O (1分)
CO2↑+4NO2↑+2H2O (1分)
![]() (6)②促进(1分) NH4++H2O NH3·H2O+H+(1分) ③ a(1分)
(6)②促进(1分) NH4++H2O NH3·H2O+H+(1分) ③ a(1分)
(7)2H2(g)+O2(g)==2H2O(l) ⊿H = -2M kJ/mol(1分)
18、(每空2分,共8分)
(1)促进, A (2)甲大
乙用氯化铵溶液稀释后,C(![]() )增大很多,使
)增大很多,使![]() 的电离平衡向抑制电离的方向移动,
的电离平衡向抑制电离的方向移动,![]() 发生水解,使稀释后的乙溶液的(
发生水解,使稀释后的乙溶液的(![]() )增大
)增大
19、(每空2分,共14分)
(1)-92.4 kJ·mol-1
(2)25% ; ①②(2分,只选一个且正确得1分,多选、错选都不得分)
(3)8NH3+3C12=N2+6NH4C1
(4)①25.0 mL; 玻璃棒、胶头滴管、烧杯、量筒(全对得2分,填对3个得1分,其他不得分) ②小于
20、(共10分)
(1)Mg2+ Ba2+ ; (2分) Cl-(1分)
(2)CO32- 0.2mol/L SO42- 0.1mol/L(各1分)
(3)是 (1分)
已知n(NH4+)=0.04mol n(CO32-)=0.02mol n(SO42-)=0.01mol由于n(NH4+)<2 n(CO32-)+ 2n(SO42-),根据电荷守恒知,必有K+(2分)