高三化学9月份教学质量检测试题
化学试题
说明:本试卷满分100分,答卷时间90分钟。第Ⅰ卷为选择题,请用2B铅笔将答案序号涂写在答题卡上,考试结束只交答题卡和第Ⅱ卷。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Fe:56
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括6个小题,每小题2分,共12分。每小题只有一个选项符合题意)
1.金属钠不仅跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
2.下列过程属于化学变化的是:①白色的硫酸铜粉末久置于空气中变成蓝色;②福尔马林用来浸制标本;③同素异形体之间的互变;④同分异构体之间的互变;⑤蜂蚁叮咬处涂稀氨水或小苏打溶液可减轻痛苦;⑥氯化钠溶液通电后导电
A.只有①②④⑤ B.只有①④⑤ C.只有①②③④⑤ D.全部
3.下列化合物中,不能通过化合反应而得到的是
A.NH3 B.Fe(OH)3 C.FeCl3 D.Al(OH)3
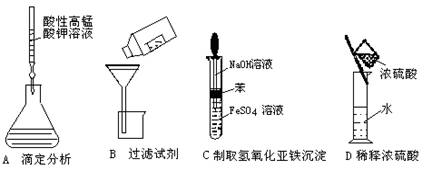
4.下列操作或仪器的选用正确的是
5.对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ,下列叙述正确的是
4NO(g)+6H2O(g) ,下列叙述正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是2v正(NH3)=3v正(H2O)
6.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②⑤ C.①②④ D.②③④⑤
二、选择题(本题包括12个小题,每小题3分,共36分。每小题只有一个选项符合题意)
7.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是
A.用“绿色化学”工艺,使原料完全转化为产物
B.大量使用农药化肥提高粮食产量
C.推广垃圾的分类存放、回收、处理
D.推广燃煤脱硫技术,防治SO2污染
8.设NA为阿佛加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数约为NA
B.常温常压下,0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
C.2 mol SO2和1 mol O2混合在(V2O5存在的条件下)密闭容器中加热反应后,容器内物质的分子数大于2NA
D.138克K2CO3晶体中的离子总数大于3NA
9.某溶液既能溶解Al(OH)3 ,又能溶解H2SiO3 ,在该溶液中一定能大量共存的离子组是
A. K+、Na+、![]() 、
、![]() B. Na+、
B. Na+、![]() 、Cl-、ClO-
、Cl-、ClO-
C. H+、Mg2+、![]() 、
、![]() D. Ag+、K+、
D. Ag+、K+、![]() 、Na+
、Na+
10.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3等五种溶液中的
一种,其中a能与其余四种溶液反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是
A.a一定为KOH B.b一定为KHSO4
C.c一定为AlCl3 D.e一定为MgCl2
11.现有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25 mL,其物质的量浓度均为0.1 mol·L-1,下列说法不正确的是
A.3种溶液pH的大小顺序是 ③>①>②
B.若将3种溶液稀释相同倍数,pH变化最大的是③
C.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>②>①
D.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①最小的是②
12.下列离子方程式正确的是
A.用石墨作电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++OH-+H++
SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++ HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
13.下列与化学有关的叙述正确的是
A.铜锌原电池中铜为负极
B.0.1 mol N2与0.1 mol H2在一定条件下反应达到平衡时,生成0.2 mol氨
C.1 mol·L-1 AlCl3溶液中,铝离子物质的量浓度为1 mol·L-1
D.18 g H2O中含1 mol氧原子
14.把过量Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡
![]() Ca(OH)2(s) Ca2+(aq)+2OH-(aq),下列说法正确的是
Ca(OH)2(s) Ca2+(aq)+2OH-(aq),下列说法正确的是
A.恒温下向溶液中加入少量CaO固体,溶液的c(OH-)增大
B.给溶液加热,溶液的pH升高
C.向溶液中加入少量Na2CO3固体,溶液的c(H+)减小
D.恒温下向溶液中加入少量CaO固体,溶液中Ca2+的物质的量不变
15.将pH=3的盐酸a L分别与下列三种溶液混合后,溶液均呈中性:
① 1×10-3 mol·L-1的氨水b L ② c(OH-)=1×10-3 mol·L-1的氨水c L
③ c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
A.b>a>d>c B.b>a=d>c
C.a=b>c>d D.c>a=d>b
16.某溶液含有①NO![]() 、②HCO
、②HCO![]() 、③SO
、③SO![]() 、④CO
、④CO![]() 、⑤SO
、⑤SO![]() 等五种阴离子。现向其中加入少量的Na2O2固体后,溶液中离子浓度增大的是(设溶液体积无变化)
等五种阴离子。现向其中加入少量的Na2O2固体后,溶液中离子浓度增大的是(设溶液体积无变化)
A.① B.①②③④ C.①④⑤ D.④⑤
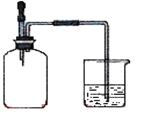 17.如右图所示,集气瓶内充满下列某混合气体,置
17.如右图所示,集气瓶内充满下列某混合气体,置
于光亮处,若将胶头滴管内的水挤入集气瓶,一段时间后
烧杯中的水就会进入集气瓶,则集气瓶中的气体不可能
是
[① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④N2、H2]
A.①② B.②④ C.①④ D.②③
18. 向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入400 mL 0.5 mol·L-1 HCl,恰好使混合物溶解,并放出气体224 mL (标准状况下),所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原质量相同的此混合物,得到铁的质量为
A.11.2g B.22.4g C.5.6g D.无法计算
安丘市高三9月份教学质量检测
化学试题
第Ⅱ卷(非选择题 共52分)
| 题号 | 三 | 四 | 五 | 总分 |
| 得分 |
|
|
|
|
| 得分 | 评卷人 |
|
|
|
三、实验题(本题包括2小题,共23分)
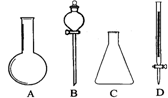 19.(9分)(1)右下图所示A、B、C、D四种仪器: 请选择下列仪器名称的序号,填人相应的空格内:①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥酸式滴定管
19.(9分)(1)右下图所示A、B、C、D四种仪器: 请选择下列仪器名称的序号,填人相应的空格内:①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥酸式滴定管
A______________ B______________ C______________ D______________
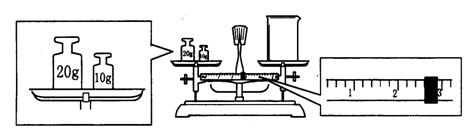 (2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g
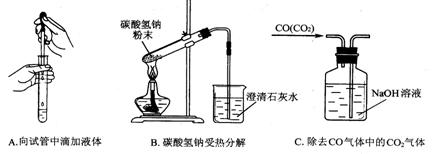 (3)指出下面3个实验中各存在的一个错误:
(3)指出下面3个实验中各存在的一个错误:
A_________________________
B__________________________
C___________________________
20.(14分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
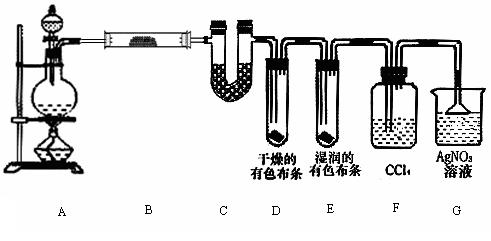
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2 ,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是
。
(2)①装置B中盛放的试剂名称为 ,作用是 ,
现象是 。
②装置C和D中出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)。
| 得分 | 评卷人 |
|
|
|
四、推断题(本题包括2小题,共23分)
21. (10分) A、B、C、D、E都是短周期元素,原子序数依次增大,A、B属于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。D、A按原子个数比3:2形成离子化合物丙。E是地壳中含量最高的金属元素。A、B均是有机化合物丁的组成元素,而且在同类化合物中丁的组成最简单。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是 ,
D元素的原子结构示意图是 。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是
(用元素符号填写)。
(3)丁能与乙醇发生酯化反应,其化学方程式为
(4)乙投入到水中发生反应的离子方程式是 22.(13分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
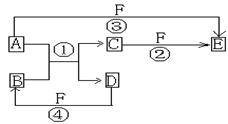
[Ⅰ]若在常温下A是常见的金属单质,D、F是气态单质,反应①需在水溶液中进行,则:
(1)试推测A D (填化学式)
(2)写出反应①的化学方程式 。
(3)E的水溶液显酸性,其原因是(用离子方程式来表示)
(4)已知1g D与F反应生成B时放出了92.3 kJ的热量,写出该反应的热化学方程
式 。
(5)在现实生活中A物质主要发生 腐蚀,其反应的正极反应式为 。
[Ⅱ]若在常温下A是非金属单质,D、F是气态的单质,反应①需在高温条件下进行,则:
试推测A E (填化学式)
| 得分 | 评卷人 |
|
|
|
五、计算题(本题包括1小题,共6分)
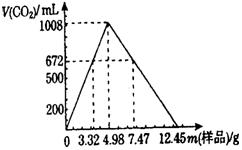
23.(6分)自然界存在的某天然碱(纯净物)的组成表示为aNa2CO3·bNaHCO3·cH2O
(a、b、c为正整数)。现称取不同质量的天然碱样品,溶于水后,分别逐滴加入相同浓度的盐酸30.0 mL,产生二氧化碳的体积(标准状况)如图所示。
|
(1)若用2.49 g样品进行同样的实验时,产生二氧化碳 mL
(标准状况)。
(2)另取3.32 g天然碱样品于300℃加热分解至完全(300℃时碳酸钠不分解),产生
112 mL二氧化碳(标准状况)和0.450 g水,试通过计算确定该天然碱的化学式为 。
(3)实验所用盐酸的物质的量浓度为 。
高三统一考试化学试题
参考答案
选择题:1、C 2、D 3、D 4、C 5、A 6、B 7、B 8、C 9、B 10、B 11、C 12、A 13、D 14、C 15、B 16、D 17、C 18、C
三、19.(共9分)(1)③⑤④⑥(各1分)
(2)砝码放在左盘,烧杯放在右盘(或砝码和物品的位置放反了)(1分)27.4(1分)
(3)A.滴管口伸人试管中 B.试管口向上 C.混合气体从短导管进入洗气瓶(各1分 )
20.(共14分)(1)浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失(2分)
(2)① 无水硫酸铜 证明有水蒸气产生 白色变蓝色(其它合理答案也给分)(3分)②氯气无漂白性,次氯酸有漂白性 (2分)③吸收氯气(1分) ④Ag-+Cl-=AgCl↓(2分)
(3)E F (2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
21.(共10分)(1)第2周期,VIA族(2分)
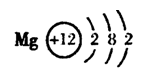
| |
(2)O < N < Al < Mg < Na (2分)
(3) 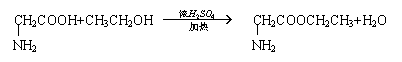
(2分)
(4)2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑ (2分)
22.(共13分)[Ⅰ](1)Fe H2 (每空1分)
(2)Fe+2HCl=FeCl2+H2↑(2分)
(3) Fe3++3H2O![]() Fe(OH)3+3H+(2分,写成“=”或标上“↓”全错)
(4)H2(g)+Cl2(g)=2HCl(g) △H= -184.6
kJ/mol(2分)
Fe(OH)3+3H+(2分,写成“=”或标上“↓”全错)
(4)H2(g)+Cl2(g)=2HCl(g) △H= -184.6
kJ/mol(2分)
(5)吸氧(1分), O2+2H2O+4e-=4OH-(2分)
[Ⅱ] C CO2(每空1分)
23.(6分,每空2分)(1)504 (2)2Na2CO3·NaH CO3·2H2O
(3)2.50 mol·L-1