高三化学上册月考测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至8页,共100分。考试时间100分钟。
第Ⅰ卷(选择题,共42分)
注意事项:
1. 每小题选出答案后,用铅笔将答案涂在选择题答题卡上。
2. 考试结束后,考生只交第Ⅱ卷。
可能用到的相对原子质量:H:1 C1:35.5 Na:23 O:16 Cu:64
N:14 S:32 Al:27
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个正确答案)
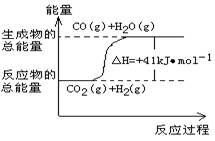
1.下列热化学方程式符合右图所示的是
| A.CO(g) + H2O(g)==CO2(g) + H2(g); △H=–41 kJ·mol-1 B. CO2(g) + H2(g) == CO(g) + H2O(g); △H= +41 kJ·mol-1 C.CO(g) + H2O(g)==CO2(g) + H2(g);△H= +41 kJ·mol-1 D.CO2(g) + H2(g) == CO(g) + H2O(g); △H= –41 kJ·mol-1 |
|
2.下列制取、检验、提纯或保存物质的方法可行的是
① 向某溶液中加入KSCN溶液检验该溶液是否含有Fe3+,② 用植物油、乙醇、NaOH溶液制取肥皂,③ 向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体,④ 用焰色反应检验
K+时须透过蓝色钴玻璃观察,⑤ 液溴用水液封后密封保存在棕色试剂瓶中,⑥ 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液,提纯乙酸乙酯。
A.①③⑤⑥ B. ②④⑤⑥ C.①②④⑤ D.①③④⑥
3.下列离子方程式不正确的是
A.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液
Ca![]() +2HCO3
+2HCO3![]() +2OH
+2OH![]() =CaCO3↓+CO32
=CaCO3↓+CO32![]() +2H2O
+2H2O
B.3 mol的Cl2 通入含2 mol FeI2的溶液中
2Fe![]() +4I
+4I![]() +3Cl2=2Fe
+3Cl2=2Fe![]() +6Cl
+6Cl![]() +2I2
+2I2
C.乙醛溶液中加入足量的银氨溶液并加热
CH3HCHO+ 2[Ag
(NH3)2]![]() +2OH
+2OH![]()
![]() CH3HCOO—+NH4
CH3HCOO—+NH4![]() +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量的CO2
C6H5O![]() +CO2+H2O→C6H5OH+HCO3
+CO2+H2O→C6H5OH+HCO3![]()
4.25℃时将NaOH溶液蒸发掉8.2g水后,再恢复到25℃析出5.8gNaOH·H2O晶体,再蒸发1.2g
水后恢复到25℃又析出5.8gNaOH·H2O晶体,则25℃时NaOH的溶解度为
A.483.3g B.61.5g C.133.3g D.333.3g
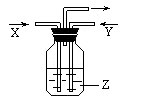
5.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如下图所示),一定
没有沉淀生成的是
| X | Y |
| |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | CaCl2 |
| D | CO2 | SO2 | CaCl2 |
6.2005年11月23日,由于中国石油吉林石化公司发生爆炸事故,检测发现苯类污染物流入
松花江,造成水质污染,致使哈尔滨市停水四天。下列关于水的说法中正确的是
A.水是一种极弱的电解质,温度越高电离程度越大
B.水是由极性键构成的非极性分子
C.高效催化剂可使水分解获得氢气,同时释放能量
D.水是一种稳定的化合物,这是由于氢键所致
7.下列各组离子能在指定环境中大量共存的是
A.在c
(AlO![]() ) = 0.1 mol/L的溶液中:Na+、Al3+、Cl
) = 0.1 mol/L的溶液中:Na+、Al3+、Cl![]() 、NO
、NO![]()
B.在由水电离出的c(H+)=1×10![]() mol/L的溶液中:Fe2+、ClO
mol/L的溶液中:Fe2+、ClO![]() 、Na+、SO
、Na+、SO![]()
C.使甲基橙变红的溶液中:Fe2+、Cl![]() 、NO
、NO![]() 、Na+
、Na+
D.在使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
8.进行下列实验肯定能获得成功的是
A.用1mol/L的盐酸与MnO2反应制取氯气
B.用湿润的淀粉碘化钾试纸鉴别二氧化氮和溴蒸气
C. 用10mL量筒准确量8.50mL稀硫酸
D.用热的浓纯碱溶液去除管壁内壁附着的油脂
9.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温时,2L 1mol/L的乙酸溶液中,所含分子总数大于2NA
B.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
C.7.8 g Na2O2含有的阴离子数目为0.2 NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
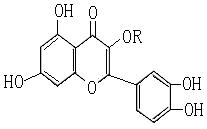
| 10.天然维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂。下列关于维生素P的叙述中错误的是 A.可以和溴水反应 B.可用有机溶剂萃取 C.分子中有三个苯环 D.1mol维生素P可以和4 molNaOH反应 |
|
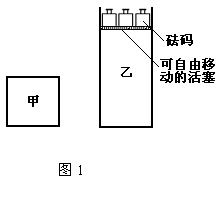 11.一定温度下,有可逆反应:2A(g)+2B(g)
11.一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B
充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积
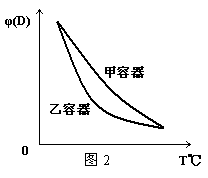 为2V(如图1)。
为2V(如图1)。
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体平
均相对分子质量也不相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
12.下列各选项中所述的两个量,前者一定大于后者的是
A.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
B.pH=10的NaOH和Na2CO3溶液中,水的电离程度
C..物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH![]() 的物质的量浓度
的物质的量浓度
D.相同温度下,10mL 0.1mol/L的醋酸与100mL 0.01mol/L的醋酸中H+的物质的量
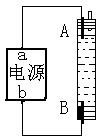
13.某同学设计了一种用电解法制取Fe(OH)2的试验装置如右图。通电后,溶液中产生白色沉淀,且较长时间内不变色,下列说法中正确的是
| A.电源中a为正极,b为负极 B.电解池中电解液可以是NaOH溶液但不能是NaCl溶液 C.A、B两端都必须使用铁作电极 D.A电极发生的反应为:2H2O + 2e |
|
14.将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶
液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中c(Na![]() )=c(Cl
)=c(Cl![]() )+c(OH
)+c(OH![]() )
)
C.最终得到15.6g的沉淀
D.最终得到的溶液中c(NaCl)=1.5mol/L
高三化学月考试题
第Ⅱ卷(非选择题,共58分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷上。
2.答卷前将密封线内的项目填写清楚。
二、本题包括2小题,共16分
15.(2分)白磷的着火点为40oC,在室温或夏天正常取出时,就可观察到其被氧化而冒“白烟”,请简单说明将如何将大块的白磷改变成小块的白磷。
答:
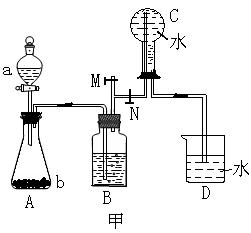
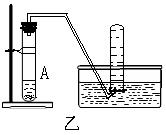
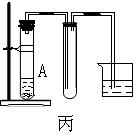
16.(14分)下列装置图甲是某种不溶于水的气体R的发生装置和收集装置
|
|
|
|
所用的试剂从下列试剂中选取2—3中:二氧化锰、铜片、硫化亚铁、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。(说明:甲装置中M和N为止水夹。)
(1)气体R的化学式是 ;
(2)所选试剂a、b是 ;装置B的作用是
。
(3)如上图所示装置乙和丙中,能代替装置甲的简易装置是 (填“乙”或“丙”),并说明理由: 。
(4)写出在试管A中所发生反应的离子方程式: 。
(5)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量且过量的浓硝酸或稀硝酸反应,所得溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,归纳了两种意见,一种意见是:Cu2+浓度差异引起的,你认为是否正确? (填“正确”或“不正确”),依据是: 。
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并且用试验进行了证明,请简述试验方案与试验现象:
。
三、本题包括2小题,共17分
17.(9分)A、B、C、D、E五种短周期元素,原子序数依次增大,已知B元素原子最外层电子数是次外层电子数的两倍,C可分别与A、D形成化合物A![]() C、A
C、A![]() C
C![]() 和D
和D![]() C、D
C、D![]() C
C![]() ;E的最外层电子数比最内层电子数多1。请回答:
;E的最外层电子数比最内层电子数多1。请回答:
(1)D![]() C
C![]() 的电子式_______________________。
的电子式_______________________。
(2)B与A_______________(填“能”或“不能”)形成与A![]() C
C![]() 电子总数相等的分子,如果能,化学式是____________(如果不能,此空不用填)。
电子总数相等的分子,如果能,化学式是____________(如果不能,此空不用填)。
(3)请写出实验室制取B![]() A
A![]() 时反应的化学方程式
时反应的化学方程式
(4)E单质可与应用最为广泛的金属的最高价氧化物反应,并生成另一种化合物F,该反应化学方程式是 。
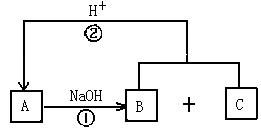
| 18.(8分)在下图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素均在短周期中。回答下列问题。(说明:图中不含R的产物均已略去,反应②的产物之一是A) |
|
(1)若A为两性无机化合物,由A转化为B和C的离子方程式为
.
(2)若A是由非金属元素组成的盐,则由A转化成B(或B、C)的离子方程式为_________________________________________________________________。
(3)若A为酸性氧化物,A与NaOH溶液反应有三种情况(只生成B、只生成C、同时生成B和C),则A为__________________________。
(4)若A可由家庭生活中两种常见的有机物合成,则A转化成B和C的化学方程式为
四、本题包括2小题,共20分
![]()
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示。
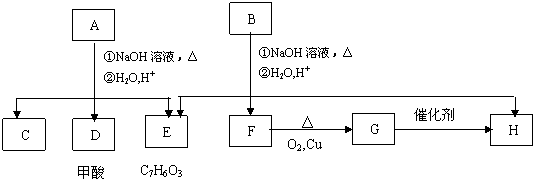 |
(1)B可以发生的反应类型有(填序号) 。
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
(2)E中含有官能团的名称是 。
(3)A有两种可能的结构,其结构简式为 , 。
(4)B、C、D、F、G化合物中互为同系物的是 。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为
20.(9分)已知硫酸在水中的电离方程式是:H2SO4====H++HSO![]() HSO
HSO![]()
![]() H++SO
H++SO![]() ,回答下列问题:
,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”),理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系不正确的是 。
A.c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO4)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HSO
)+c(H2SO4)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HSO![]() )
)
C.c(Na+)+c(H+)=c(OH-)+c(HSO![]() )+2c(SO
)+2c(SO![]() )
D.c(Na+)=2c(SO
)
D.c(Na+)=2c(SO![]() )+2c(HSO
)+2c(HSO![]() )
)
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO![]() )=0.029 mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO
)=0.029 mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO![]() )
0.029 mol·L-1(填“<”,“>”或“=”)。
)
0.029 mol·L-1(填“<”,“>”或“=”)。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是: 。
五、本题包括1小题,共5分
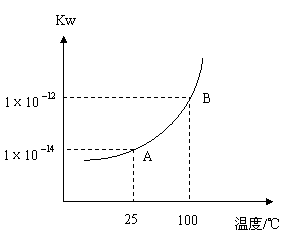
| 21.水的电离平衡曲线如右图所示: (1)若A、B两点分行分别表示25
。 |
|
(2)100![]() 时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所有得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所有得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
(3)100![]() 时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
。
时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
。
化学试题答案
一、1.B 2.C 3.A 4.C 5.D 6.A 7.D 8.D 9.A 10.C
11.D 12.C 13.A 14.D
二、15:用镊子夹取白磷,在盛有水的水槽中切割(其它合理答案给分)
16:(1)NO (2)稀硝酸 铜片,用蒸馏水洗去NO2
(3)乙; 装置乙可以除去NO2,而丙不能除去
(4)3Cu
+ 8H+ + 2NO![]() ==3Cu
==3Cu![]() + 2NO↑ + 4H2O
+ 2NO↑ + 4H2O
(5)不正确;铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的铜离子的浓度相同;将绿色溶液加热,有红棕色气体产生,溶液变蓝色,说明后一种推断正确。
17:(1)![]() (2)能,C
(2)能,C![]() H
H![]()
(3)CH![]() CH
CH![]() OH
OH![]() CH
CH![]() =CH
=CH![]() ↑+H
↑+H![]() O
O
(4)2Al+Fe![]() O
O![]()
![]() Al
Al![]() O
O![]() +2Fe
+2Fe
18:(1)![]()
(2)![]()
(3)![]()
(4)![]()
19:(1)①④ (2)羟基、羧基
(3)
(4)C、F
(5) CH3COOH + CH3CH2OH
![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
20.(10分)(1)如下图 (2)0.5mol /L (3)H2和CO(或H2和CO2或H2O和CO)
(4)0.5mol/L
| |
(2)1:9(3)![]()
 Z
Z