高三化学上册月考测试题
化 学 试 卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.满分100分,考试时间90分钟.
第Ⅰ卷(选择题 共48分)
可能用到的相对原子质量 :H—1 C—12 N—14 O—16 Na—23 S—32 Mg—24 Fe—56 K—39 Si—28
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分。)
1.亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A.在中毒过程中血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时血红蛋白被还原
2.下列依据热化学方程式得出的结论正确的是
A.已知:2H2(g)+O2(g)=2H2O(g); △H=-483.6 kJ· mol-1
则氢气的燃烧热为241.8 kJ· mol-1
B.已知:C(石墨,s)=C(金刚石,s); △H>0
则金刚石比石墨稳定
C.已知:NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l); △H=-57.4 kJ· mol-1
则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量
D.己知:2C(s)+2O2(g)=2CO2(g));△H1 2C(s)+O2(g)=2CO(g);△H2,
则△H1>△H2
3.下列关于盐的反应规律的说法中不正确的是
①盐和酸反应一定生成另一种盐和另一种酸 ②盐和碱反应一定生成另一种盐和另一种碱 ③两种盐反应一定生成另外两种盐 ④阳离子相同的两种盐一定不能反应⑤碱金属形成的盐一定不会水解 ⑥酸与碱反应只生成盐和水
A.只有①③④⑤ B.只有③④⑥ C.只有③④⑤ D.①②③④⑤⑥
4.20℃时,将a g硝酸钾溶于b g水中,恰好形成V mL饱和溶液。下列关系式错误的是
A. 该溶液物质的量浓度c(KNO3)= ![]() mol/L
mol/L
B. 该溶液中的溶质质量分数ω(KNO3)= ![]() %
%
C. 20℃时硝酸钾的溶解度S= ![]() g
g
D. 该溶液的密度ρ= ![]() g/L
g/L
5.我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
 |
则下列叙述错误的是:
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作用到了坩埚、玻璃棒、酒精灯等实验仪器
6.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2 KClO3 + H2C2O4
+ H2SO4 ![]() 2 ClO2↑+
K2SO4+ 2 CO2↑+2H2O下列说法正确的是
2 ClO2↑+
K2SO4+ 2 CO2↑+2H2O下列说法正确的是
A. KClO3在反应中得到电子 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. 1 molKClO3参加反应有2mol电子转移
7.下列反应的离子方程式不正确的是
A.等物质的量的Ba(OH)2与NH4HSO4在溶液中反应:
Ba2+ + 2 OH -+NH4 ++H ++ SO4 2-=BaSO4↓+NH3·H2O + H2O
B.用氯化铁溶溶液液制氢氧化铁胶体 Fe3+ + 3 H2O ![]() Fe(OH)3(胶体)+ 3 H+
Fe(OH)3(胶体)+ 3 H+
C.溴化亚铁溶液中通入等物质的量的氯气:2Fe2++2Br -+2C12==2Fe3++Br2+4C1-
D.碳酸氢钠溶液中滴入少量澄清石灰水: Ca2++ HCO3- + OH- =CaCO3↓+ H2O
8. 在一定条件下化学反应:N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4kJ/mol 现有容积相同的甲、乙、丙三个定容容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2NH3(g);△H=-92.4kJ/mol 现有容积相同的甲、乙、丙三个定容容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | N2(mol) | H2(mol) | Ar(mol) | Q(kJ) |
| 甲 | 1 | 3 | 0 | Q1 |
| 乙 | 0.5 | 1.5 | 0 | Q2 |
| 丙 | 0.5 | 1.5 | 0.5 | Q3 |
根据以上数据,下列叙述一定正确的是
A.2Q2<2Q3<Q1<92.4 B.在恒压容器中与恒容容器中生成1 molNH3气体放热不相等
C.Q1=2Q2=2Q3=92.4 D.若丙改为恒压容器,其它条件不变,则有Q2>Q3
9.分类或推理是学习和研究化学的一种常用的科学方法。下列分类或推理正确的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
⑥ 依据物质相对分子质量,推断物质熔、沸点的高低
⑦ 依据气体的摩尔质量,推断相同状态下不同气体密度的大小
A.②③ B.②⑤⑦ C.①②④⑥ D.①②⑤⑥⑦
10.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐七种物质的稀溶液相互反应,符合离子方程式2 H+ + SO32- = H2O + SO2↑ 的化学方程式个数有
A.4 B.6 C.8 D.12
11. 由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的是
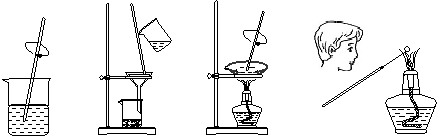
A.溶解 B.过滤 C.蒸发 D.焰色反应
12.在含有I-离子且滴加酚酞显红色的溶液中,能大量共存的离子组是
A.Na+、K+、ClO-、Cl- B.Na+、Ba2+、Fe3+、Cl-
C.SO42-、NO3-、Fe2+、Al3+ D. Cl-、SO32-、Na+、K+
13.将![]() 通入
通入![]() 溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则另一气体可能是
溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则另一气体可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.60.0g二氧化硅晶体中,含有“Si—O”键的数目为2NA
B.34g过氧化氢分子中极性共价键的数目为NA
C.标准状况下,22.4L甲烷和氨气的混合气体所含有的电子总数约为10NA
D.1mol/L Na2SO4溶液中,Na+ 和SO42- 离子数的总和是3NA
15.已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
16.使a g Fe粉与一定量的硝酸溶液充分反应(Fe粉完全溶解),生成的气体与标准状
况下b L O2混合后,恰好能被水完全吸收,a和b的关系可能是
A. b >0.3a B.b <0.2a C.0.2a≤b ≤0.3a D.无法确定
化 学 试 卷
第Ⅱ卷(非选择题 共52分)
注意事项:
1 .第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷上。
2 .答卷前将密封线内的项目填写清楚。
| 得分 | 评卷人 |
|
17.(6分)(1)下面所列的是中学化学实验室中几种常见的仪器:
容量瓶 、酸式滴定管、碱式滴定管、温度计、量筒 、托盘天平、 普通漏斗 、烧杯
①若要进行中和滴定实验,还缺少的玻璃仪器是 ;
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
③使用酸式滴定管的第一步操作是 ;
④中和热测定时,一次完整实验,温度计应使用 次。
(2)下列实验最后结果数值偏小的是
A.配一定物质的量浓度溶液时,药品与砝码放反了,游码读数为0.3g,所得溶液浓度
B.酸碱中和滴定时,滴定终点仰视标准液滴定管读数,所测的待测液浓度
C.中和热测定实验时,用铜质搅拌棒代替环形玻璃搅拌棒,所得的中和热的数值
D.测定硫酸铜晶体结晶水含量时坩埚上有高温不分解的固体物质,所得结晶水的含量
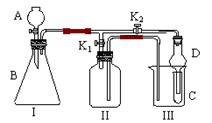 18.(10分)某兴趣小组同学共同设计了如
18.(10分)某兴趣小组同学共同设计了如
图所示的实验装置。该装置既可用于制取气
体,又可用于验证物质的性质。
⑴ 打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,
但装置II只能收集H2、NH3,不能收集O2。其理由是 。
乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。你认为他的改进方法是 。
⑵ 打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是 ;仪器D在该装置中的作用是 。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是 。
| 得分 | 评卷人 |
|
19.(13分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
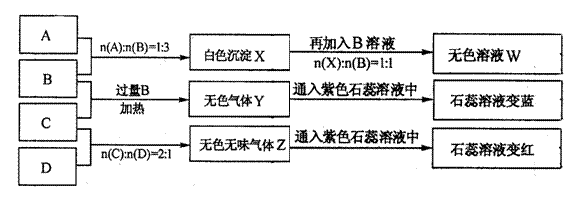 |
请回答:
(1)Y、Z的化学式分别为:Y ;Z 。
X与B反应的离子方程式为 。
(2)D溶液的pH 7(填“大于”、“小于”或“等于”),其原因是 。(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式
。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是 。
20.(15分)(Ⅰ)据报道,意大利科学家使用普通氧分子和一种特殊的微粒作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A、O4分子内存在极性共价键 B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体 D、O4将来可用作更强有力的火箭推进的氧化剂
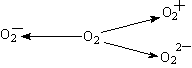
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中 (填序号)相当于氧分子的还原。
(3)化合物O2[PtF6]中含有O![]() ,有一种常见的含有O
,有一种常见的含有O![]() 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式: __________________________________________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式: __________________________________________
(Ⅱ).发射火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴ 写出N2H4的电子式________________;
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为________________________;
⑶ 在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4
+ H3O+ ![]() N2H5+ + H2O N2H4 + H2O
N2H5+ + H2O N2H4 + H2O
![]() N2H5+ + OH -
N2H5+ + OH -
N2H5+ + H2O ![]() N2H62+ + OH - N2H5+ + H2O
N2H62+ + OH - N2H5+ + H2O ![]() N2H4 + H3O+
N2H4 + H3O+
据此可得出的结论是_______ _;
A.肼水解显酸性 B.肼在水中电离出H+ 离子 C.肼是二元弱碱 D.肼是二元弱酸
⑷ 完成下列反应方程式并配平:
__ NH3 + ___ NaClO == ___ NaCl + ___ N2H4 + _________ ___;
⑸ 发射火箭时肼(N2H4)为燃料,二氧化氮气体作氧化剂,两者反应生成氮气和气态水。已知4 gN2H4(g)上述反应中放出71kJ的热量,写出该反应的热化学方程式
_____________________________________________________ ______.
| 得分 | 评卷人 |
|
21. (8分)石油化工排放的废水常含有多种还原性物质。向水样中加入稍过量的重铬酸钾标准溶液,充分反应后,再用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,以检测石油化工废水中还原性物质的含量。
⑴ 配制0.010mo1·L-1标准硫酸亚铁铵溶液500 mL时,需称取硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]的质量为 g。
⑵ 硫酸亚铁铵标准溶液在空气中放置后浓度会发生变化,需用重铬酸钾标准溶液标定硫酸亚铁铵溶液的实际浓度。现取0.0040 mo1·L-1重铬酸钾标准溶液10.00 mL,滴定时,用去25.00 mL硫酸亚铁铵溶液,则硫酸亚铁铵标准溶液的实际浓度为 (K2Cr2O7的还原产物为Cr3+) 。
⑶ 实际操作中,检测人员在标定标准硫酸亚铁铵溶液浓度时,每次取浓度值为c的重铬酸钾标准溶液10.0 mL,计算时只要测出滴定中消耗的标准硫酸亚铁铵溶液体积V(单位mL) ,就可以依据一个简单的计算式直接计算出标准硫酸亚铁铵溶液的实际浓度。该计算式为 。
参考答案
1B 2C 3D 4A 5A 6A 7D 8B 9B 10B 11D 12D 13C 14C 15D 16C
17.(1)①锥形瓶 ②玻璃棒胶头滴管 ③检查是否漏水 ④3 (2)AC
18.(共10分)
(1)氧气的密度比空气大(2分);
(2)将装置II中装滿水(其它合理答案参照给分) (2分);
(3)溶液呈橙色等(其它合理答案参照给分)(2分);防止倒吸(2分);
(4)比较醋酸、碳酸和苯酚的酸性:CH3COOH >H2CO3>C6H5OH等(2分)
(其它合理答案参照给分)。
19.(共13分)(1)NH3;CO2 每空1分共2分
Al(OH)3+OH—=AlO- +2H2O 2分
(2)大于; 1分
CO3 2-+H2O ![]() HCO3- +OH— 2分
HCO3- +OH— 2分
(3)NaOH>Na2CO3>AlCl3>NH4HSO4 2分
(4)NH 4++H++2OH—= NH3↑+2H2O 2分
(5)Na+>SO42- >NH >H+=OH—
20(15分)(Ⅰ)(1) CD(2分) (2)①③(2分) (3) 4KO2 + 2CO2 = 2K2CO3+ 3O2 (2分)
![]() (Ⅱ)(1) (2分)
(Ⅱ)(1) (2分)
(2)2NH3![]() NH4++NH2-(2分)。(3)C(1分)
NH4++NH2-(2分)。(3)C(1分)
(4)2NH3+NaClO=NaCl+N2H4+H2O。(2分)
(5) N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g);△H=-568kJ/mol。(2分)
21.(8分)(1)1.96(2分)(2)0.0096m0l/L(3分 )(3)60c/v m0l/L(3分)