高三化学上册期末联考模拟试卷
第一卷(选择题 共48分)
一:选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列表述正确的是
①现代研制的油漆中一般不使用甲醛、酚类等化合物,因为这些化合物对人体有毒②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长③我国禁止汽车使用含铅汽油,其主要原因铅资源短缺④明矾能使水中的悬乳物凝聚,可做为净水剂⑤赤潮、白色污染、绿色食品都与相关物质颜色有关⑥给机动车安装尾气净化器,可减少光化学烟雾的发生⑦开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
A.①③④⑤⑥ B.①②④⑥⑦ C.②③④⑤⑥ D.全部
2.有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42-
3.短周期的A、B两种元素,A原子半径小于B原子半径,两种元素可形成A是正价的AB2型化合物,下列关于两元素的叙述正确的是
①A、B可能属于同一周期 ②A是B的前一周期元素
③A只能是金属元素 ④A可能是第二周期ⅡA族或ⅣA族元素
下列选项正确的是
A.①③ B.②③ C.②④ D.②③④
4.下列化学反应在金属冶炼工业中还没有得到应用的是:
A.2NaCl(熔融) ![]() 2Na + Cl2↑
2Na + Cl2↑
|
C.Fe2O3
+ 3CO ![]() 2Fe + 3CO2↑
2Fe + 3CO2↑
D.2Ag2O
![]() 4Ag + O2↑
4Ag + O2↑
5.下列有关物质性质的描述不正确的是
A.SO2气体通入溴水中使溴水褪色,属于氧化还原反应
B.葡萄糖与新制的Cu(OH)2浊液加热产生砖红色沉淀,证明葡萄糖有还原性
C.BrCl与Br2、Cl2的化学性质相似,则BrCl+H2O=HBr+HClO
D.在Al(OH)3胶体中加入Ba(OH)2溶液至过量,先有沉淀后沉淀溶解
6.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10—8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10—5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3—) >c (Cl—) >c (Ag+)>c (I—)
B.c (K+)>c (NO3—) >c (Ag+) >c (Cl—)>c (I—)
C.c (NO3—)>c (K+)>c (Ag+) >c (Cl—)>c (I—)
D.c (K+)>c (NO3—) >c (Ag+) = c (Cl—) + c (I—)
7.设阿伏加德常数为NA。则下列说法正确的是
A.常温下,2.7g铝与足量的浓硫酸反应,失去的电子数为0.3NA
B.64g的铜发生氧化还原反应,一定失去2NA个电子
C.标准状况下,0.3 mol 双氧水中含有电子数为5.4NA
D.常温常压下,1mol氦气含有的核外电子数为4NA
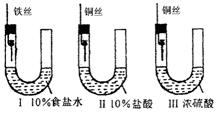 8.某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在右图示的三个装置中,放置一星期后观察现象,下列描述错误的是
8.某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在右图示的三个装置中,放置一星期后观察现象,下列描述错误的是
A.装置Ⅰ的U形管铁钉一侧的液面一定会上升
B.装置Ⅱ中的铁钉腐蚀最严重
C.比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低
D.装置Ⅲ中的铁钉几乎没被腐蚀
二:选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意)
9.如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
![]()
关于该化合物的下列说法中,不正确的是
A.该有机物的化学式为C20H14O5
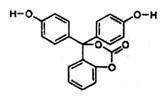 B.该有机物可以与浓溴水反应
B.该有机物可以与浓溴水反应
C.与足量氢氧化钠溶液充分反应,所得产 物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应
|
A.a:Cl—;b:K+;c:CO32—;d:HCO3—
B.a:K+;b:CO32—;c:Cl—;d:HCO3—
C.a:K+;b:CO32—;c:HCO3—;d:Cl—
D.a:K+;b:HCO3—;c:Cl—;d: CO32—
11.Na3N与NaH均为离子化合物,都能与水反应放出气体。下列有关叙述正确的是
A.二者中Na+半径都比阴离子大
B.与水反应时,水都作氧化剂
C.与水反应所得溶液均能使酚酞试液变红
D.二者与盐酸反应,前者可产生两种盐,后者只有一种盐生成。
12.下列实验过程中产生的现象与对应的图形符合的是
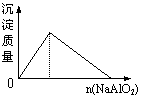 | |||
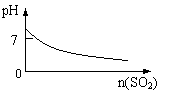 | |||
A.盐酸中加入NaAlO2溶液 B.SO2气体通入溴水中
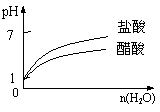 |
C.pH=1的醋酸与盐酸分别加水稀释 D.氨气通入醋酸溶液中
13.下列反应的离子方程式正确的是
A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
B.氢氧化铁与足量的氢碘酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C. 足量CO2通入饱和碳酸钠溶液:CO2+CO32—+H2O=2HCO3—
D.向碳酸氢钙溶液中滴入过量澄清石灰水:
Ca2++HCO3—+OH— =CaCO3↓+H2O
14.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
第二卷(非选择题 共72分)
15.下列有关物质分离提纯的方法正确的是 (填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来;
②水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精;
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离;
④由于氯化钠的溶解度随温度变化改变较小,所以可用冷却法从热的含有少量硝酸钾的氯化钠浓溶液中分离得到纯净的氯化钠晶体;
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出;
⑥用排饱和食盐水的方法收集氯气可除去氯气中混有的少量氯化氢气体;
⑦由于粗铜中混有Zn、Fe等比Cu活泼的金属,电解时也会溶解,所以不可用电解法提炼高纯度的铜;
⑧除去FeC13溶液中混有的少量FeC12:加入足量铁屑,充分反应后,过滤。
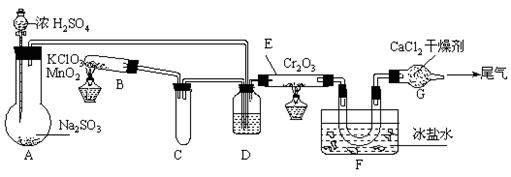
16.实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ·mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ·mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ① ② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
![]() 17.德国人哈件在18905年发明的合成氨反应原理为:N2(g)+3H2(g) 2NH3(g)已知298K时:△H=-92.4kJ·mol—1△S=-198.2J·K—1·mol—1
17.德国人哈件在18905年发明的合成氨反应原理为:N2(g)+3H2(g) 2NH3(g)已知298K时:△H=-92.4kJ·mol—1△S=-198.2J·K—1·mol—1
试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298K下合成氨反应能否自发进行(保留一位小数)
;在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ? 。
|
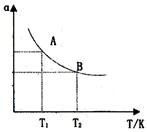
于一个10L密闭容器中,反应达到A平衡时,混合气体中
氨占25%,试回答:
①N2的转化率αA为 。
②在状态A时,平衡常数KA= (代入数值
的表达式,不要求得出具体数值)当温度由T1变
化到T2时,KA KB(填“>”、“<”或“=”)
(3)在实际工业合成氨生产中采取的措施是 (填序号)
A.采用较低压强 B.采用700K左右的高温C.用铁触媒作催化剂
|
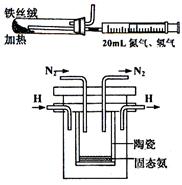
(4)右图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法
。在1998年然腊亚里斯多
德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温常压下高转
化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
18.(1)已知下列反应在一定的条件下可以发
生:H2O2 +2Fe2+ +2 H+ ==2Fe3+ +2H2O H2O2 +2Fe3+== 2Fe2+ + O2↑+ 2H+ 在以上反应中Fe2+实际上起着_________作用。
(2)I2也是Fe2+一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:H2O2 + I2==2HIO, _________________________,
总反应式为____________________________。
(3)在H2SO4 和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色。并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2 +2 I—== I2+ O2↑+ 2H+ ,这个方程式正确吗?____________。若正确,理由是(若认为不正确,该步不必作答)_______________________,若不正确,原因是(若认为正确,该步不做答)__________________。并写出正确的化学方程式为(若是离子反应,写出离子反应方程式,没有离子反应的,写出化学方程式):_____________________ 、 。
19.物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的无色医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。
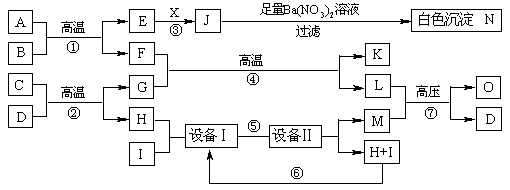
回答下列问题:
⑴X的化学式为_______________,
C+D的反应方程式为____ _______ __
⑵写出反应⑦的化学方程式_____________________________________。
⑶现有1molA参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①的化学方程式为_____________________。
20.煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:C+H2O(g)——CO+H2,CO和H2的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH3COOH互为同分异构体,既能与银氨溶液反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题:
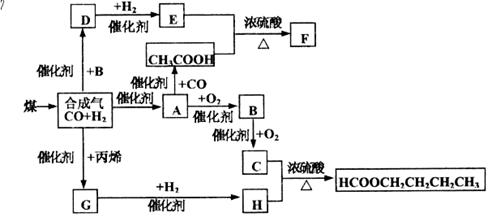 (1)写出下列物质的结构简式:E___________B__________;E与H是否属于同系物:________________(填是或否)。
(1)写出下列物质的结构简式:E___________B__________;E与H是否属于同系物:________________(填是或否)。
(2)D的同分异构体除CH3COOH外还有:___________________-;
(3)写出下列反应的化学方程式:
C+H_____________________________________________;
D与银氨溶液反应________________________________________。
(4)A为工业常用燃料。某同学将A完全燃烧,产生的二氧化碳气体通入澄清石灰水中。
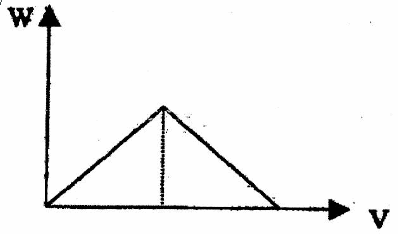
①产生沉淀的量W随通入二氧化碳(至过量)的体积V而变化,可用图像直观地表达。请在下边画出这一关系图象。
②若该同学实验时共取了200mL0.1mol/L的石灰水,通入一定量的二氧化碳后,得到1g沉淀,那么,他通入的二氧化碳的体积可能为: ____
21.有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。
请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
 (2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为
。
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为
。
(3)写出D原子的核外电子排布式 _,
C的氢化物比D的氢化物在水中溶解度大得多的可能原 因 。
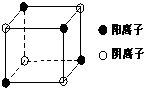
(4)右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为 ,FeD2物质中具有的化学键类型为 。
参考答案
1.B. 2. B. 3. C. 4. B. 5. C. 6. A.7. C. 8. C. 9. D. 10 C. 11 CD. 12. C. 13 CD. 14. B.
15.(3分)③⑤⑥
16(11分,每空1分)(1)检查装置的气密性 (2)水与浓硫酸作用放热,有利于SO2的放出
(3)缓冲、防止倒吸(答一即得1分)
(4)浓硫酸。①干燥SO2和O2 ②使SO2和O2混合均匀 ③通过观察控制气体比例和气流速度
(5)温度过高不利于SO3的生成,且影响催化剂的活性
(6)无(白)色晶(固)体(7)防止水蒸气与SO3接触(8)用NaOH溶液吸收
17.(共15分)(1)△H-T△S=-92.4kJ—1·mol—1-298K×(-198.2×103)kJ·mol—1=-33.3(kJ·mol—1)<0,(或-33336.4(J·mol—1),所以反应能够自发进行。
该反应为可逆反应,10mol N2和30mol H2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ
(2)①40% ②![]() (单位错扣1分);> …………(1分,其余每空2分)
(单位错扣1分);> …………(1分,其余每空2分)
(3)BCD
(4)用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成。
N2+6e—+6H+=2NH3
18.(1)催化剂(1分)
![]() (2)H2O2 +
2HIO ==I2+O2↑+2H2O (2分)2H2O2 2H2O+O2↑(2分)
(2)H2O2 +
2HIO ==I2+O2↑+2H2O (2分)2H2O2 2H2O+O2↑(2分)
(3)不正确(1分) 反应中只有化合价升高而没有化合价降低(2分)
![]() 2H++2I-+H2O2
==I2+2H2O(2分)
2H++2I-+H2O2
==I2+2H2O(2分)
2H2O2 2H2O+O2↑(2分)
19.(8分)
⑴ H2O2 (2分) C+H2O![]() CO+H2
(2分)
CO+H2
(2分)
⑵CO2+2NH3![]() CO(NH2)2+H2O
(2分)
CO(NH2)2+H2O
(2分)
⑶Fe4S5+8O2![]() 2Fe2O3+5SO2(2分)
2Fe2O3+5SO2(2分)
20.(11分,除注明外,其余每空1分)
(1)HOCH2CH2OH HCHO 否
(2)HCOOCH3
(3)![]()
![]()
(4)①
②(2分) 0.224L或0.672L
21(物质结构与性质,12分)
(1)② (2分)
(2)SP3 (1分) 分子晶体 (1分)
(3)1S22S22P63S23P4 (2分) NH3与水分子形成氢键且更易发生化学反应 (2分)
(4)1:1 (2分) 离子键、非极性键 (2分)