高三化学上册第一次摸底考试试题
化 学 试 题
本试卷分为第Ⅰ卷和第Ⅱ卷两部分。考试结束后,将答题纸和答题卡一并交回。
第Ⅰ卷(共35分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、考试科目涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡
皮擦干净后,再选涂其他答案标号,不能答在试题卷上。
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Cl 35.5 S 32 Fe 56
一、选择题:(本题包括10小题。每小题只有一个选项符合题意。每小题2分,共20分)
1.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是 ( )
A.用“绿色化学”工艺,使原料完全转化为产物
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥提高粮食产量
2.科学家经过不断的科学实验,初步获得了室温下水可以变成冰,不导电的塑料通过加入添加剂也能导电等科学认识。这说明 ( )
A.科学实验是人们获得认识的唯一途径
B.科学实验是人们认识的一个重要来源
C.科学实验是人类最基本的实践活动
D.科学实验是认识的最终目的
3.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于![]() Y的说法中不正确的是 ( )
Y的说法中不正确的是 ( )
A.钇元素位于周期表第五周期 B.质子数与中子之差为50
C.原子的核外电子数是39 D.![]() Y和
Y和![]() Y是两种不同的核素
Y是两种不同的核素
4.设阿伏加德罗常数的值为NA,则下列说法中正确的是 ( )
A.常温常压下,11.2L N2所含的原子数目为NA
B.标准状况下,11.2L H2O中含有的电子数为5NA
C.常温下,1mol Al2(SO4)3中含Al3+数为2NA
D.常温下,2.7g铝与足量的盐酸反应,产生氢气的分子数为0.1NA
5.下列反应的离子方程式正确的是 ( )
A.钠与水反应:2Na+2H2O=2Na++2OH—+H2↑
B.向氯化铝溶液中滴加氨水:Al3++3OH—=Al(OH)3↓
C.氯气与水反应:Cl2+H2O=2H++Cl—+ClO—
D.向溴水亚铁溶液中通入少量氯气:Cl2+2Br—=2Cl—+Br2
6.在无色透明溶液中一定能大量共存的一组离子是 ( )
A.Ba2+、Ca2+、NO3—、Cl— B.Cu2+、Fe2+、NO3—、H+
C.Al3+、NH4+、AlO2—、OH— D.Ag+、Fe3+、SO42—、Cl—
7.离子检验的常用方法有三种
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应有气体产生 |
下列离子检验的方法不合理的是 ( )
A.NH4+—气体法 B.Cl——沉淀法 C.Fe3+—气体法 D.OH——显色法
8.同温同压下两个容积相等的贮气瓶,一个装有H2气体,另一个装有O2和N2的混合气体,则两瓶内的气体一定不相同的是 ( )
A.气体质 B.气体的物质的量 C.分子总数 D.原子数
9.短周期元素X、Y的原子序数相关差2。下列有关叙述正确的是 ( )
A.X与Y不可能位于同一主族 B.X和Y一定位于同一周期
C.X与Y不可能形成共价化合物XY2 D.X与Y可能形成离子化合物XY
|
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
二、选择题(本题包括5小题。每小题只有一个选项符合题意。每小题3分,共15分)
11.某非金属单质A和O2发生化合反应生成B。B为气体,其体积是参加反应的O2体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是 ( )
A.有1个氧原子 B.有2个氧原子 C.有1个A原子 D.有2个A原子
12.下列实验不能达到预期目的的是 ( )
| 代号 | 实验内容 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯与溴的非金属性强弱 |
| B | 向饱和Na2SiO3溶液中通入二氧化碳 | 比较碳与硅的非金属性强弱 |
| C | 把碳酸钠与亚硫酸钠放置在空气中 | 比较碳与硫的还原性强弱 |
| D | 向氯化铜溶液中加入铁丝 | 比较碳与铜的还原性强弱 |
13.已知下列三组实验:①向KMnO4晶体上滴加浓盐酸,产生氯气;②向FeCl2溶液中通入少量氯气,溶液变黄色;③取实验②中生成的溶液滴在淀粉KI试纸上,试纸变蓝色。则下列判断不正确的是 ( )
A.实验①能够证明Cl—具有还原性
B.上述实验不能证明Fe2+具有氧化性
C.上述实验能够证明氧化性:MnO4—>Cl2>Fe3+>I2
D.由上述实验不能判断氯气能滞使湿润的淀粉KI试纸变蓝
14.用0.1mol/L的Na2SO3溶液30mL,恰好将2×10—3mol的XO4—离子还原,则元素X在还原产物中的化合价是 ( )
A.+1 B.+2 C.+3 D.+4
15.将标准状况下的a L氯化氢气体溶于100g水中,得到的盐酸的密度为b g/mL,则该盐酸的物质的量浓度(mol/L)是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
|
注意事项:
1.用钢笔或圆珠笔直接答在答题纸上,不要答在试卷上。
2.本卷共5题,共65分。
三、本题包括1小题,共8分。
16.(8分)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg→Cu2HgI2+2Cu
(1)上述反应产物Cu2HgI4中,Hg元素显 价。
(2)以上反应中的氧化剂为 ,当有1mol Cu2HgI4生成时,转移电子数
个。
(3)CuI可由Cu2+与I—直接反应制得,请配平下列反应的离子方程式(化学计量数必须全部填写)。
![]()
![]()
![]()
![]() Cu2++
I—→
CuI+
I3—
Cu2++
I—→
CuI+
I3—
四、本题包括1小题,共12分。
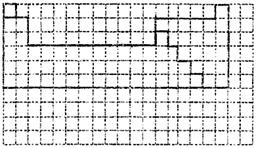
17.(12分)Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它
的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。
Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X ,Y ,M 。
(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应:
(3)Y与Z相比,非金属性较强的元素是 ,可以证明该结论的实验是(用离子方程式表示)
。
五、本题包括1小题,共12分。
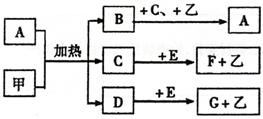
18.(12分)已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,
|
|
写出反应C→F+乙的化学方程式: 。
每生成1mol乙气体,需要转移 mol电子。
(2)气体B可用与B含有同一种元素的气体化合物M与其发生氧化还原反应而转化,M的化学式是 ,M与B反应的化学方程式为 。
六、本题包括1小题,共17分。
19.(17分)某同学欲利用教材中的实验装置探究“铝热反应”中熔融物的成份。请写出“铝
热反应”的化学方程式: ,该同学经查阅《化学手册》知Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | …… |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。其理由是:
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是 ,反应的离子方程式为 。
(3)该同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确(填“正确”或“不正确”) ,理由是(用离子方程式表示)
(4)若要测定该熔融物中铝元素的含量,请设计实验,写出所用试剂的名称和实验步骤(不用写化学方程式)。
七、本题包括1小题,共16分。
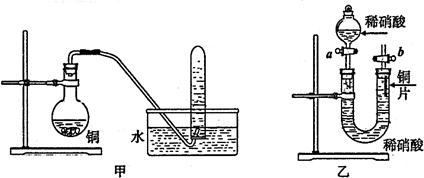
20.(16分)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实
验中发生的有关问题。
Ⅰ.探究上述四种酸氧化相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸
④稀硝酸,能随即发生反应的是(填序号,下同) ,微热则发生反应的是 ,加热后发生反应的是 ,加热也不发生反应的是
。由此可以得到上述四种酸氧化性由强到弱的顺序是:
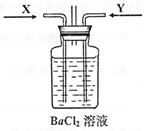
|
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是
A.HNO3的酸性比H2SO4强
B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
|
(1)写出铜和稀硝酸反应的离子方程式 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填:“能”或“不能”),请简述理由(包括化学方程式)是
(3)若用实验装置乙进行实验,检查装置气密性的操作是
参考答案
一、选择题(每小题只有一个选项符合题意,每小题2分,共20分)
|
二、选择题(每小题只有一个选项符合题意,每小题3分,共15分)
11.A 12.C 13.D 14.D 15.C
三、
16.(每空2分,共8分)(1)+2 ⑵CuI 1.20×1024(或1.20×1024,或2NA)
(3)2 5 2 1
四、
17.(方程式和轮廓线每个、每线2分外,其余每空均1分,共12分)
|
Ⅱ.⑴
O CI H
(2)Si+2OH—+H2O=SiO32—+2H2![]() (3)CI,Cl2+S2—=2Cl—+S
(3)CI,Cl2+S2—=2Cl—+S![]()
五、
18.(每空2分,共t2分)
(1)H2SO4 Na2CO3 2Na2O2+2H2O=4NaOH+O2![]() 2
2
|
六、19(17分)
2AI+Fe2O3 A12O3+2Fe(2分)
(1)铝热反应得到熔融态的铁,此温度下铝也为熔融态,二者融合在一起形成铁铝合金(2分)
(2)氢氧化钠溶液(1分) 2Al+2OH—+2H2O=2A1O2—+3H2 ![]() (2分)
(2分)
(3)不正确(1分) Fe2O3+6H+=2Fe3++ 3H2O (2分)
2Fe3++Fe=3 Fe2+,6 Fe3++2Al=2A13++6 Fe2+ (这两个方程式只要答出其中一个就给2分)
(4)①称量实验所得熔融物质量为m1
②将熔融物加入足量盐酸溶解,(过滤)
③(向滤液中)再加入足量氢氧化钠溶液后过滤,(并洗涤沉淀,将滤液和洗涤液合并)
④向溶液(滤液)中通入足量二氧化碳,(过滤并洗涤沉淀)
⑤称量蚶埚质量为m2,取沉淀置于坩埚中灼烧至恒重,冷却称量其质量为m3
⑥计算积w(A1)=9(m3-m2)/17 m1×100%
说明:本部分共5分。其中①与⑤两项全对得1分。其余每步1分(括号内的内容不答可不扣分)
七、20(共16分)
I.(1)每空1分,共5分。 ③、④、①、②;③>④>①>②
(2)每项1分,共2分(每错答l项倒扣1分)。 B C
(3)答出4项得2分,答出3项得1分,答出1项和2项的不得分(每错答1项倒扣1分)。
B C D E
Ⅱ(1)3Cu+8H++2NO3—=3Cu+2NO![]() +4H2O(2分)
+4H2O(2分)
(2)不能(1分),因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2(1分), 2NO+O2=2NO2(1分)。
(3)关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少最水后漏斗中的水不再下滴并能保持此状态一段时问,则说明该装置的气密性良好(2分)。