高三化学上册第一次联考试卷
化学试卷
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Cl-35.5 Cu-64
K-39 Zn-65 Br-80 Ag-108 F-19 Ca-40 Fe-56 S-32
第I卷(选择题,共66分)
一、单选题(本题共10分),每小题2分,只有一个正确选项。
1、为实现“绿色奥运”,下列环保建议中你认为可以采纳的是( )
①用天然气代替汽油和柴油作为发动机燃料
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发利用无磷洗涤剂
A.①③④ B.②③④⑤ C.①②④⑤ D.全部
2、下列各项中表达正确的是( )
A.Si的原子结构示意图:![]() B.聚乙烯的结构简式
B.聚乙烯的结构简式![]()
C.NH3的电子式:![]() D.HCl的电子式:
D.HCl的电子式:![]()
3、简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A.①②③互为同素异形体 B.①②③互为同位素
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
4、从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
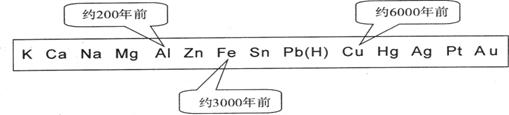
A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
5、下列过程中属于化学变化的是( )
①白色的硫酸铜粉末久置于空气中变成蓝色 ②同素异形体之间的互变
③福尔马林用来浸制标本 ④同分异构体之间的互变
⑤乳酸聚合成的纤维降解 ⑥氯化钠溶液通电后导电
A.只有①②④⑤ B.①②③④⑤⑥ C.只有③④⑤ D.只有①④⑤
二、单选题(本题36分),每小题3分、只有一个正确选项。
6、某温度下,体积一定的密闭容器中进行如下可逆反应:
![]() X(g)+Y(g)
Z(g)+W(g)—Q;(Q>0 )下列叙述正确的是( )
X(g)+Y(g)
Z(g)+W(g)—Q;(Q>0 )下列叙述正确的是( )
(A)升高温度,平衡逆向移动
(B)当容器中气体压强不变时,反应达到平衡
(C)平衡后加入X,上述平衡正向移动,X的平衡转化率增大
(D)平衡后加入少量W,逆反应速率增大
7、2004年七月,德俄两国化学家共同宣布,在高压下,氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160kJ·mol-1,而N≡N键的键能为942 kJ·mol-1。则下列有关说法不正确的是( )
A.键能越大说明化学键越牢固,所构成的物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N):n(N-N)=1:3
D.用作炸药或高能材料可能是高聚氮潜在的应用
8、下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO![]() )=0.1mol/L的溶液中:NH
)=0.1mol/L的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO![]()
C.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.在使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
9、某一胶体进行电泳实验时,胶体微粒向阴极移动,对胶体进行下列操作时,能使胶体发生凝聚的是①加入酒精;②加入MgSO4溶液;③加入Fe(OH)3溶胶;④加入H2SiO3溶胶;⑤降低温度( )
A、②③ B、②④ C、①③ D、①⑤
|
A.该有机物的分子式为C3H7O2N
B.该有机物名称为α-氨基丙酸
C.该有机物能发生加成反应
D.该有机物能发生酯化反应
11、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要反应方程为:
![]() 2Fe(OH)3+3ClO-+4OH-
2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-
2FeO42-+3Cl-+5H2O
![]() 干法制备的主要反应为:2FeSO4+6Na2O2
2Na2FeO4+2Na2O+2Na2SO4+O2↑
干法制备的主要反应为:2FeSO4+6Na2O2
2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
A.高铁酸钾中铁显+6价 B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
12.从下列事实所列出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
A.③④⑤ B.②③⑤ C.①②③ D.全部
13、下列离子方程式正确的是( )
![]() A、溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2
2Fe3++2Br2+6Cl-
A、溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2
2Fe3++2Br2+6Cl-
![]() B、实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++Cl2↑+2Cl-+2H2O
B、实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++Cl2↑+2Cl-+2H2O
![]() C、用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq) CuS(s)↓
C、用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq) CuS(s)↓
D、1L0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
![]() H2SO4(aq)+2NaOH(aq)
Na2SO4(aq)+2H2O(1)+57.3
kJ·mol-1
H2SO4(aq)+2NaOH(aq)
Na2SO4(aq)+2H2O(1)+57.3
kJ·mol-1
14、A和B两元素分别得到两个电子后,都变成零族元素的电子层结构,其中A放出的能量比B大,因此( )
 A、A比B容易被还原
B、A2-的还原性比B2-的强
A、A比B容易被还原
B、A2-的还原性比B2-的强
C、A的氧化性比B弱 D、A2-比B2-的半径大
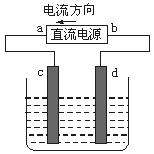
15、下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下 列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
16、已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C)。其中正确的是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
17、用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2 溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2 溶液体积(V)间的关系图正确的是( )
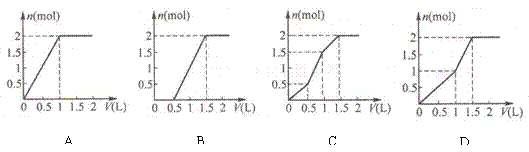
三、不定项选择(本题共20分),每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分:有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18、下列各项操作中,不发生“先产生沉淀后沉淀又溶解”现象的是( )
A、向饱和碳酸钠溶液中通入过量的CO2
B、 向Fe(OH)3胶体中逐滴滴加入过量的稀硫酸
C、向氨水中逐滴加入AgNO3溶液至过量
D、向石灰水中通入过量的CO2
19、化学与数学有密切的联系,将某些化学知识用数轴表示,可以受到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中错误的是( )
A、 分散系的分类
![]() 分散系微粒直径(nm)
分散系微粒直径(nm)
B、AlCl3溶液中滴加NaOH溶液后Al元素的存在形式
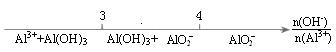
C、铁与稀硝酸反应后溶液中铁元素的存在形式
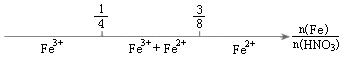
D、CO2通入澄清石灰水中反应的产物
![]()
20、下图所示对实验仪器名称的标注或实验操作正确的是( )
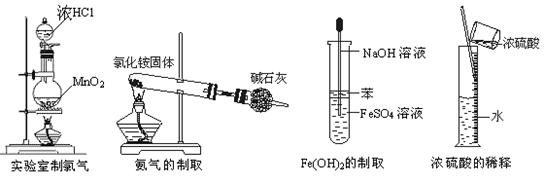
A B C D
21、下列叙述正确的是( )
A 、在标准状况下,22.4 L NO 与11.2 L O2 充分反应后,所得气体的分子数为 NA
B、一定条件下,52.0 g乙炔与苯蒸气的混合气体中含有的碳原子数约为4×6.02×1023
C、1 L 1 mol/L 的FeCl3 溶液中含有三价铁离子数目小于 NA
D、 标准状况下,1 L 辛烷完全燃烧所生成气态产物的分子数为 8/22.4 NA
22、含A克硝酸的溶液与B克铁恰好完全反应,若有A/2克硝酸被还原,则A与B之比可能是( )
A、9:3 B、27:4 C、6:1 D、4:1
第II卷(非选择题,共84分)
四、填空题
23、不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
(3)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(4)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
![]()
![]() 24、(1)1986年化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
24、(1)1986年化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
K2MnF6+ SbF5 KSbF6+ MnF3+ F2,反应中 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出:
①(CN)2与KOH溶液反应的化学方程式:
②在NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式:
③AgCN沉淀在见光时发生反应的化学方程式为:
25、下图表示373K时,反应A(g) 2B(g)在前110s内的反应进程(将该反应看作匀速进行的)
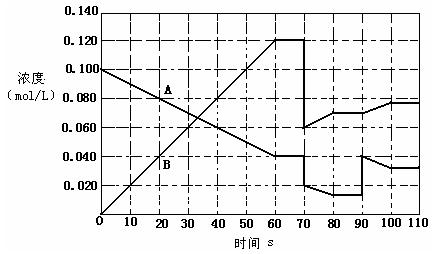
| T(K) | 273 | 323 | 373 |
| K | 0.005 | 0.022 | 0.36 |
(1)此反应的平衡常数的表达式K=_____________。
![]() (2)A(g) 2B(g)在不同温度下的K值见上表,则该反应的逆反应为__________(填“吸热”或“放热”)反应。
(2)A(g) 2B(g)在不同温度下的K值见上表,则该反应的逆反应为__________(填“吸热”或“放热”)反应。
(3)升高温度,B的转化率__________(填“增大”、“减小”或“不变”,下同),B的反应速率_______________。
(4)373K时,在一密闭容器中,将A气体放入进行反应,据图判断,80-90s内反应向哪个方向移动___________(填“向左”、“向右”、“不移动”),90s时曲线变化的原因是(用文字表达)_________________________,反应进行到70s时,改变的条件可能是(填编号)_____________________
A、加入催化剂 B、扩大容器体积
C、升高温度 D、增大A的浓度
五、实验题
26、测定硫酸铜晶体(CuSO4• 5H2O)里结晶水的含量,实验步骤为:研磨;‚称量空坩埚和装有试样的坩埚的质量;ƒ加热;„冷却;…称量†重复ƒ至…的操作,直到连续两次称量的质量差不超过0.1为止;⑦根据实验数据计算硫酸铜结晶水的含量。试回答下列问题:
(1)现有坩埚、坩埚钳、三角架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,还缺少的实验仪器是_______________
(2)该实验中,需要使用干燥器的步骤是________(填步骤的编号);使用干燥器的目的是_____________________。
(3)实验步骤†的目的是_____________________
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有______________
A、被测样品中含有加热不挥发的杂质
B、被测样品中含有加热易挥发的杂质
C、实验前被测样品已有部分失水
D、加热前所用的坩埚未完全干燥
(5)若空坩埚质量为M1克,装有试样的坩埚的质量为M2克,加热冷却后平均质量为M3克,则1mol该硫酸铜晶体中所含结晶水的物质的量的计算式为________
27、早在20世纪90年代,国际上提出了“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节能都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是 。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是 。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便的远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
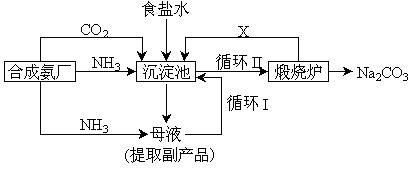
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
⑤母液中含有 ,(以化学式表示)。向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
六、有机化学
28、在含羰基![]() 的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。当两个 烃基都是脂肪烃基时,叫脂肪酮,如甲基酮
的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。当两个 烃基都是脂肪烃基时,叫脂肪酮,如甲基酮
![]() ;都是芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮
;都是芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮![]() 。
。
像醛一样,酮也是一类化学性质活泼的化合物,如羰基也能进行加成反应。加成时试剂的带负电部分先进攻羰基中带正电的碳,而后试剂中带正电部分加到羰基带负电的氧上,这类加成反应叫亲核加成。但酮羰基的活泼性比醛羰基稍差,不能被弱氧化剂氧化。许多酮都是重要的化工原料和优良溶剂,一些脂环酮还是名贵香料。
试回答:
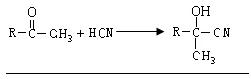
(1)写出甲基酮与氢氰酸(HCN)反应的化学方程式
(2)下列化合物中不能和银氨溶液发生反应的是。_________(多选扣分)
(a)HCHO (b)HCOOH (c)![]() (d)HCOOCH3
(d)HCOOCH3
(3)有一种名贵香料:灵猫香酮![]() 是属于 (多选扣分)
是属于 (多选扣分)
(a)脂肪酮 (b)脂环酮 (c)芳香酮
(4)樟脑也是一种重要的酮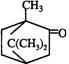 ,它不仅是一种家用杀虫剂,且是香料、塑料、医药工业重要原料,它的分子式为
。
,它不仅是一种家用杀虫剂,且是香料、塑料、医药工业重要原料,它的分子式为
。
29、有机化学反应因反应条件不同,可生成不同的有机产品。例如:
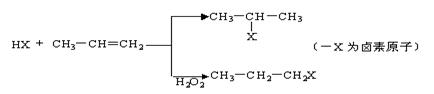
(1) 苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;在催化剂的作用下,苯环上的氢原子被卤素原子取代。
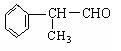
(2)工业上利用上述信息,按下列路线合成结构简式为
的物质,该物质是一种香料。
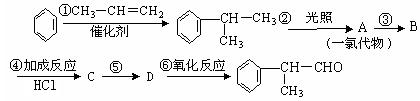
请根据上述路线,回答下列问题:
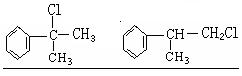
(1)A的结构简式可能为_______________________________________。
(2)反应③、⑤的反应类型分别为_________、_________。
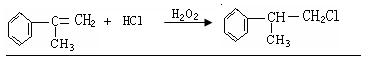
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
__________________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是___________________________________________________。
(5)这种香料是具有多种同分异构体,其中某种物质有下列性质:①该物质的水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述两条件的物质可能的结构简式。(只写两种)
________________________________________________________。
七.计算:(本题16分)
30.(6分)2004年7月22日,因上游突降暴雨,淮河污染史上最大污水团形成,并"扫荡"淮河干流,充斥河面的黑色污染水团全长达133公里,总量约4亿吨。环境监测测定此污水团水中溶解氧的方法是:①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液,立即塞好瓶塞,反复顛倒振荡,使之充分反应。其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。②测定:开塞后迅速加入1~2mL浓硫酸(提供H+)使之生成I2,有关反应式为MnO(OH)2+2I-+4H+=Mn2++I2+3H2O ,再用b mol·L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗了VmL溶液,滴定中S2O32-离子变成了S4O62-离子。
(1) 试写出水中溶解氧的计算式(以g·L-1为单位)。
(2) 若量取污水团水样1250mL, 消耗了10.00mL的0.05000mol·L-1Na2S2O3溶液,试通过计算说明此污水团为何所到之处有大量鱼类死亡?(已知:200C,常压下O2在纯水中的溶解度为0.0092g/L,鱼在含氧量<0.004g/L的水中,不能生存。)
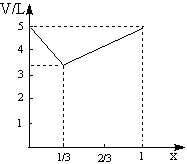
31、已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:
(1)当Cl2与NO2混合气体以不同比例混合时,测得其平均相对分子质量分别为51和61,分别求出Cl2在上述混合气体中的体积分数 、 。
(2)取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,由此写出Cl2和NO2反应的化学方程式 。
 (3)设Cl2的体积分数为x(0<x<1),试讨论当x的取值不同时(Cl2与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表
(3)设Cl2的体积分数为x(0<x<1),试讨论当x的取值不同时(Cl2与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表
| X值 | V(反应后混合气体体积) |
(4)请在右图中画出反应后的总体积V随x变化的函数图象。

高三第一次联考
化学答题纸
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总分 |
|
| 10 | 36 | 20 | 24 | 24 | 20 | 16 | 150 |
| 实得分 |
|
|
|
|
|
|
|
|
一、选择题:
| 1 | 2 | 3 | 4 | 5 |
二、 选择题:
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
三、选择题:
| 18 | 19 | 20 | 21 | 22 |
四23、
(1) <x(Mg)< , <x(N)< 。
(2) _________________ 。 。
(3) 。
(4) ____________ 。
![]() 24、(1)
24、(1)
K2MnF6+ SbF5 KSbF6+ MnF3+ F2 ,_______
(2)
①___________________
②
③
25、
(1)K=_____________。
(2) __________(填“吸热”或“放热”)反应。
(3)__________(填“增大”、“减小”或“不变”,下同),_______________。
(4)___________(填“向左”、“向右”、“不移动”),________________,_________
五、26、
(1)_______________
(2)________(填步骤的编号);_____________________________________。
(3)_______________________________________
(4)______________ (5)______________________________________
27、(1) 。
(2) 。
(3)
① , 。
②________________________ 。
③ 。
④ 、 。
⑤ , 。
六、
28、 (1)___________________________________________
(2)_____________。
(3) (4) 。
29、
(1)_______________________________________。
(2)_________、_________。
(3)____________________________________________________________。
(4)_______________________________________________________________。
(5)_______________________________________________________________。
七.
30、(1)
(2)
31、
(1) 、 。(2) 。
| X值 | V(反应后混合气体体积) |
(3)

(4)
高三模拟考试
化学试卷答案
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总分 |
| 应得分 | 10 | 36 | 20 | 24 | 24 | 20 | 16 | 150 |
| 实得分 |
|
|
|
|
|
|
|
|
一、选择题:(2*5=10分)
| 1 | 2 | 3 | 4 | 5 |
| C | A | B | B | B |
二、 选择题:(3*12=36)
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| D | C | D | B | C | C | B | A | A | C | C | C |
三、选择题:(4*5=20)
| 18 | 19 | 20 | 21 | 22 |
| A、C | A、D | A、C | B、C | B、C |
四23、
(1)(4分) 0.93 <x(Mg)< 1.57, 2.25 <x(N)< 3.44 。
(2)(2分)同周期,同主族元素原子半径越大,X值越小。 周期性 。
(3)(1分) 共价键 。
(4)(1分) 第IA族,第六周期 。
![]()
![]() 24、(1)(3分)
24、(1)(3分)
2 K2MnF6+ 4 SbF5 4 KSbF6+ 2 MnF3+
1 F2 ,
(2)
![]() ①(1分)(CN)2+2KOH KCN+KCNO+H2O
①(1分)(CN)2+2KOH KCN+KCNO+H2O
![]() ② (1分) (CN)2+
2SCN—
(SCN)2 +2CN—
② (1分) (CN)2+
2SCN—
(SCN)2 +2CN—
![]() ③(1分) 2AgCN 2Ag+CN2
③(1分) 2AgCN 2Ag+CN2
25、
(1)(2分)K=_![]() _。
_。
(2)(1分) _放热_(填“吸热”或“放热”)反应。
(3)(2分)减小__(填“增大”、“减小”或“不变”,下同),_增大____。
(4)(3分)不移动(填“向左”、“向右”、“不移动”),增大A的浓度 _,_B
五、26、
(1)(3分)___研钵、托盘天平、酒精灯_
(2)(2分)__④_(填步骤的编号);_防止硫酸铜吸收水份_________。
(3)(2分)_保证硫酸铜晶体中的结晶水全部失去__
![]() (4)(2分)A、C__(5)(2分)
(4)(2分)A、C__(5)(2分)
27、(1)(1分) D 。
(2)(2分) B、D 。
(3)
①(2分) 联合制碱法或侯德榜制碱法 ,化肥或电解液或焊药等。
②(2分)NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓ 。
③(1分) CO2 。
④(2分) I 、 过滤 。
⑤ NaCl、NH4Cl、NH4HCO3 (3分), a、c (2分)。
 六、
六、
28、 (1)(2分)
(2)(2分) _C_。
(3)(2分) b (4)(2分)C10H16O 。
 29、
29、
(1)(2分)
(2)(2分)_消去反应___、__取代反应__。
(3)(2分)
(4)(2分)__因A有两种结构,最后所得产物中有其它杂质_。
(5)(4分)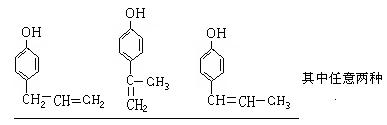 。
。
七.
30、(1)![]() (3分)
(3分)
(2)8×0 .0500×10.00/1250g·L-1=0.0032g/L<0.004g/L ,所以鱼类不能生存,污水团所到之处大量死亡。(3分)
31、
(1) 20% 、 60% 。(2分)(2) C12+2NO2=2NClO2 。(2分)
| X值 | V(反应后混合气体体积) |
| 0<x≤ | V=(5-5x)L |
|
| V=2.5(x+1)L |
(3)(每格1分)
(4) (2分)
 应得分
应得分