08届高三化学第一次考试试卷
可能用到的相对原子质量:C:12 O:16 H:1 Fe:56 Na:23 S:32 Cu:64 Cl:35.5
Si:28 P:31 N:14
一.选择题(每小题3分,本题共48分。每小题只有一个选项符合题意)
1.下列含有非极性键的离子晶体是( )
①醋酸钠 ②氢氧化钾 ③过氧化钠 ④金刚石 ⑤乙醇 ⑥氯化钙
A.①②③⑥ B.①③ C.①③④⑤ D.①②⑥
2.在下列比较中,正确的是 ( )
A.热稳定性:PH3>H2S>HCl>HF B.分子中的键角:CH4=H2O<CO2
C.分子间作用力:HF>HCl>HBr>HI D.晶体熔点:石英>食盐>冰>干冰
3.把固体加工成直径为1~100nm的超细颗粒即成为纳米材料,今有直径为20nm的超细粉末分散于适当的溶剂中,所形成的分散系不可能具有的性质是( )
A.能发生丁达尔现象 B.能透过半透膜
C.能透过滤纸 D.通直流电某极周围颜色加深
4.运用化学知识可以解决日常生活中遇到的许多问题,下列说法不正确的是( )
A. 用双氧水的稀溶液清洗伤口可以杀菌消毒 B.明矾净水
C.用淀粉溶液检验食盐中是否加碘盐 D.实验室可用 FeCl3溶液止血
5.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素的M层电子数为(a-b),L层电子数为(a+b)。则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
6.下列反应的离子方程式书写正确的是 ( )
A.以铜一铝为电极,浓硝酸为电解质构成原电池,电池负极反应式:Al-3e—=Al3+
B.用惰性电极电解饱和氯化镁溶液:2Cl—+2H2O Cl2↑+H2↑+2OH—
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
D.向 Ba(OH)2溶液中逐滴加入 NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+ NH4+十 H++SO42-=Ba SO4↓+ NH3· H2O+ H2O
7.下列关于晶体的叙述中,不正确的是 ( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
8.下列有关实验的叙述,不正确的是( )
A.用盐析法分离高级脂肪酸钠和甘油的混合溶液
B.用渗析法除去鸡蛋白溶液中混有的少量Na+和Cl-
C.实验室测定硫酸铜晶体(CuSO4·xH2O)结晶水含量时,若加热失水后露置在空气中冷却,则实测的X值比理论值偏大
D. 如果使用浓酸和浓碱溶液测定中和热,将使测定结果偏高
9.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e=2Br- ②2Br-—2e=Br2
③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和① C.③和① D.④和①
10.用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,若电解前后温度变化忽略不计,下列有关溶液叙述正确的有( )
①该溶液的pH可能增大②该溶液的pH可能减小③该溶液的pH可能不变④该溶液的浓度可能增大⑤该溶液的浓度可能不变
A.①②③④⑤ B.只有①②④⑤ C.只有①③⑤ D.只有②③
11.下列说法正确的是(NA为阿伏加德罗常数)( )
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为4NA
D.60gSi02中含Si—O键的个数为2NA
12.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)=CO(g); △H=-393.5 kJ/mol
O2(g)=CO(g); △H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g); △H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H =-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l); △H =-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l); △H =-1 400 kJ/mol
13.已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ/mol B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
14..将SO3溶解在硫酸中所得到的混合物叫做"发烟硫酸",通常以三氧化硫的质量分数表
示其组成。今将0.1185g发烟硫酸试样溶于水,用0.125mol/L的NaOH标准液滴定,
用此标准液20mL时恰好中和,则试样中SO3的质量分数为( )
A.15% B.17% C.34% D.60%
15.在CuSO4+FeS2+H2O→Cu2S+FeSO4+H2SO4反应中(末配平),下列说法正确的是 ( )
A.CuSO4是氧化剂,FeS2是还原剂
B.1mol CuSO4能氧化硫的物质的量是![]() mol
mol
C.Cu2S既是氧化产物又是还原产物
D.产物中的SO![]() 离子只有一部分是氧化产物
离子只有一部分是氧化产物
16.用惰性电极电解M(NO3)X的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况)。从而可知M的相对原子质量为( )
A.22.4ax/b B.5.6ax/b C. 11.2ax/b D.2.5ax/b
二.填空(本题包括5小题,共41分)
17.(本题共6分)
(1)(2分)石墨晶体结构如下图所示,每层由许多个正六边形构成,则:
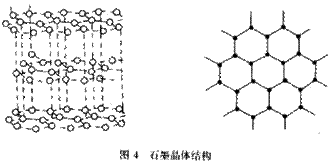
①平均每个正六边形占有碳原子数为
。
②每一层内碳原子数目与C—C化学键数目的比是
。
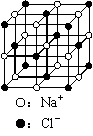 (2)(4分) 下图为氯化钠晶体结构。
(2)(4分) 下图为氯化钠晶体结构。
①若Na+ 、Cl-的最近距离是a cm, 则氯化钠晶体的密度是
g/cm3。
②在23.4 g NaCl晶体中含有
个(用NA表示阿伏加德罗常数)上图所示的结构单元。
18. (本题共6分) 在Fe(OH)3胶体中逐滴加入HI稀溶液,会出现一系列变化。
(1)先出现红褐色沉淀,原因是
。
(2)随后沉淀溶解,溶液呈黄色。写出此反应的离子方程式:
。
(3)最后溶液颜色加深,原因是
,写出此反应的离子方程式
。
![]() 19.(8分)接触法制硫酸的某阶段的反应为:2SO2
(g)+ O2 (g) 2SO3
(g);
19.(8分)接触法制硫酸的某阶段的反应为:2SO2
(g)+ O2 (g) 2SO3
(g);
△H= -196.64kJ /mol。
(1)该反应在
(填一种设备)中进行,这种设备中部的装置叫
,其作用是
。
(2)在实际生产中,为实现较快的反应速率及较大的转化率,采用的条件是
。
(3)在上述条件下,将1molSO2和0.5molO2充入某密闭容器中,放出的热量
(填“大于”、“小于”或“等于”)98.32kJ。
(4) 实验室用4mol SO2与2mol
O2进行上述反应,当放出314.624KJ热量时,SO2的转化率为
。
20.(本题共13分)甲、乙两池电极材料都是铁棒与碳棒。请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:

①有红色物质析出的是:甲池中的
棒;乙池中的
棒。
②在乙池中阳极的电极反应式是
。
(2)若两池中均为饱和NaCl溶液。
①写出乙池中总反应的离子方程式
。
②甲池中碳极上电极反应式是
。乙池碳极上电池反应属于
(填氧化或还原)反应。
③将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为
。
④若乙池转移0.02mol电子后停止实验,池中溶液的体积是200ml,则溶液混匀后的pH=
。
21. (本题共8分)
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Al3+、Ba2+、Fe3+和阴离子OH-、CO32-、SO42-、NO3-两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少但不会完全消失;C与D反应生成有色沉淀;B与C反应生成白色沉淀。写出它们的化学式:
A B
C D
三.实验题(本题11分)
22.近年来全世界经历了多种传染性疾病(如非典、疯牛病、高致病性禽流感等)的袭扰,因此,经常性地对环境进行消毒,是预防各种传染性疾病的有效措施。某研究小组为制备消毒液(主要成分是NaClO),设计了A、B两套装置(B装置中电极材料均为石墨)。并查阅到下列资料:在加热的情况下卤素单质和碱液发生如下反应:
3X2+6OH-![]() 5X-+
5X-+![]() +3H2O
+3H2O
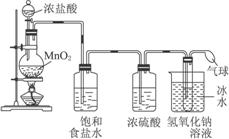
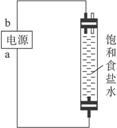
装置A 装置B
请完成下列问题:
(1)写出装置A烧瓶中发生反应的化学方程式________________________________ 。
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的_________(填“能”或“不能”)。
(3)装置A中盛冰水的烧杯的作用是_________________________________________。
(4)利用装置B制备消毒液时有关反应的化学方程式为__________________________。
(5)装置B中a端应接电源的_________极,理由是________________________________。
四.计算题(本题8分)
23.工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ ——_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。 (2)计算工业甲醇的质量分数。
答 题 卡
一.选择题(每小题3分,本题共48分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
二.填空(本题包括5小题,共41分)
17.(本题共6分)
(1)(2分) ①
; ②
。
(2)
(4分)①
g/cm3; ②
。
18. (本题共6分)
(1)
。
(2)
。
(3)
;
。
19.(8分)
(1)
; ;
。
(2)
。
(3)
。(4)
。
20.(本题共13分)
(1) ①
;
。
②
。
(2) ①
。
②
; 。
③
。④pH=
。
21.(本题共8分)
A B
C D
三.实验题(本题11分)
22.
(1)
。
(2)
。
(3)
。
(4)
。
(5)
;
。
四.计算题(本题8分)
23.(1)配平第②步中离子方程式。
_____Cr2O72—+_____Fe2++_____H+ ——_____Cr3++______Fe3++______H2O
(2)计算工业甲醇的质量分数。
参 考 答 案
一.选择题(共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | D | B | C | B | D | B | C |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | A | B | D | A | A | D | B |
17.(本题共6分) (1)① 2 (1分) ②2:3 (1分)
(2)①58.5/2a3NA (2分) ② 0.1NA(2分)
18.(6分) (1)加入电解质,使胶体凝聚 (1分) (2) Fe(OH)3+3H+=Fe3+ + 3H2O (2分)
(3) Fe3+ 与I-反应生成I2 (1分) 2 Fe3+ + 2 I-=2Fe2+ + I2 (2分)
19.(1)接触室;热交换器;使反应生成的热传递给进入接触室需预热的炉气,同时冷却生成的气体(2)500℃,V2O5催化剂 (3)小于。(4)80%
(3)和(4)每空2分,其余每空1分。本题共8分
20. (本题共13分)
(1)① 碳棒;铁棒 (各1分) ② 4OH-4e= 2H2O + O2↑ (2分)
(2)①2Cl-+2H2O![]() 2OH- +H2↑+Cl2↑ (2分)
2OH- +H2↑+Cl2↑ (2分)
②O2 + 2H2O +4e= 4OH-(2分) ;氧化(1分)
③5Cl2 + I2 +6H2O=10HCl +2HIO3 (2分) ④pH=13 (2分)
21(每空2分,本题共8分)
A.Ba(OH)2 B.Al2(SO4)3 C.K2CO3 D.Fe(NO3)3
22. (本题共11分)(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
(2分)
MnCl2+Cl2↑+2H2O
(2分)
(2)能 (1分)
(3)防止发生副反应,生成NaClO3 (1分)
(4)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ (2分)
2NaOH+H2↑+Cl2↑ (2分)
2NaOH+Cl2====NaClO+NaCl+H2O(或NaCl+H2O![]() NaClO+H2↑)(2分)
NaClO+H2↑)(2分)
(5)正(2分) 使生成的Cl2充分与阴极生成的NaOH反应,并防止Cl2从上部的导管逸出污染环境 (1分)
23.(8分)⑴1、6、14、2、6、7 (3分)
⑵由反应②可知,反应①剩余的n(Cr2O72—)=![]() n(Fe2+)=0.0016 mol (1分)
n(Fe2+)=0.0016 mol (1分)
反应①消耗的n(Cr2O72—)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol (2分)
w(CH3OH)=![]() ×100%=90.7% (2分)
×100%=90.7% (2分)