08届高三化学第一次联考试题
命题人:聂琼祥 审题人:丁建国
本试题分为第Ⅰ卷和第Ⅱ卷两部分,总分108分,
考试用时60min
可能用到的相对原子质量:C:12 O:16 Mg:24 Al:27 S:32 Cl:35.5
Ca:40 Ba:137
第Ⅰ卷(共48分)
一、选择题(本题共12个小题,每小题4分,共48分。每小题只有一个选项符合题意)
1、在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A、分子晶体 B、原子晶体
C、离子晶体 D、何种晶体无法判断
2、接触法制硫酸的过程中,对废气、水、渣、热的处理正确的是①尾气用氨水处理②污水用石灰乳处理③废渣用来制水泥、炼铁④设置热锅炉产生蒸气、供热或发电
A.①②③④都正确 B.只有①②③正确
C.只有②③④ 正确 D.只有①②④ 正确
3、下列有关实验事故的处理或实验操作的叙述中,正确的是
A.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤
B.用分液漏斗将甘油和水的混合液体分离
C.若皮肤不慎沾到苯酚,应立即用酒精清洗
D.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
4、在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、![]() 、Ba2+、Al3+、SO42-、HCO3-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括K+和OH-)有
、Ba2+、Al3+、SO42-、HCO3-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括K+和OH-)有
A、4种 B、5种 C、6种 D、7种
5、下列物质性质的变化规律,与键的健能大小无关的是( )
A、F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B、HF、HCl、HBr、HI的热稳定性依次减弱
C、金刚石的硬度、熔点、沸点都高于晶体硅
D、CH3CH2OH、H2O、CH3COOH与Na反应由难到易
6、下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.氯化铝溶液中加入过量氨水 Al3++3NH3•H2O=Al(OH)3↓+3NH4+
C.0.1mol溴化亚铁中滴入含Cl20.1mol氯水:
![]() 2Fe2++4Br-+3Cl2=2Fe3++2Br2
+6Cl-
2Fe2++4Br-+3Cl2=2Fe3++2Br2
+6Cl-
D.浓盐酸跟二氧化锰混合共热
7、MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(1) 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
![]() (2) 除去反应混合物中的不溶物
(2) 除去反应混合物中的不溶物
(3) 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤(1)中MnO2和H2SO4都是氧化剂
B.硫酸在生产中可循环使用
C.步骤(1)中每析出12.8g S沉淀共转移0.8mol电子
D. 电解时MnO2在阳极处产生
8、工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2。为了便于监控,实施环境保护,下列适合测定硫酸尾气SO2含量的是
A、品红溶液 B、氨水、酚酞试液
C、碘水、淀粉溶液 D、以上都能
9、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH+H2O(l)=CO2(g)+3H2(g);△H=+93.0kJ/mol
②CH3OH+1/2O2(l)=CO2(g)+2H2(g);△H=-192.9kJ/mol
下列说法正确的是
A、CH3OH的燃烧热为192.9 kJ/mol
 B、CH3OH的燃烧热为764.7 kJ/mol
B、CH3OH的燃烧热为764.7 kJ/mol
C、CH3OH的燃烧热为392.7 kJ/mol
D、不能算出其燃烧热
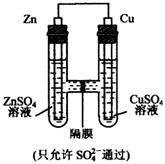
10、如图所示,下列叙述不正确的是
A、该装置是原电池
B、锌为正极,发生氧化反应
C、硫酸根离子从右流向左
D、铜棒的质量会增重
11、在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO->I2>SO42-
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D. 次氯酸钠可以与亚硫酸钠共存
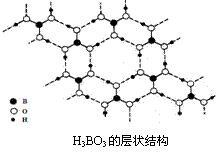 12、正硼酸(H3BO3)是一种类似于石墨的片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如右图所示)。下列有关说法正确的是
12、正硼酸(H3BO3)是一种类似于石墨的片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如右图所示)。下列有关说法正确的是
A.正硼酸晶体属于原子晶体
B.H3BO3分子熔沸点较高
C.分子中硼原子最外层为8电子稳定结构
D.含1molH3BO3的晶体中有3mol氢键
第Ⅱ卷(共60分)
二、填空题
13、(12分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,确定一定存在的离子是 ;可能存在的离子是 ;
一定不存在的离子是 。
14、(15分)A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
分别取它们的水溶液进行实验,结果如下:①A溶液分别其他四种溶液反应,均有沉淀;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是:A ;B ;C ;
D ;E 。
 15、(20分)常见的粗盐主要含有NaCl和少量的MgCl2、CaCl2,由于有MgCl2和CaCl2的存在,使得食盐容易板结,下面实验可以确定粗盐中NaCl的质量分数,也可以制得纯净的NaCl,根据实验步骤填写下列空白:
15、(20分)常见的粗盐主要含有NaCl和少量的MgCl2、CaCl2,由于有MgCl2和CaCl2的存在,使得食盐容易板结,下面实验可以确定粗盐中NaCl的质量分数,也可以制得纯净的NaCl,根据实验步骤填写下列空白:
①调整托盘天平零点
②称取样品W克
③将样品溶解于适量的蒸馏水
④滴加稍过量的A溶液,有沉淀产生,沉淀完全后过滤
⑤将得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W1克
⑥滤液中加入稍过量的B溶液,又待沉淀完全后过滤
⑦将⑥得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W2克
⑧在最后得到的滤液中加入稍过量C溶液,加热蒸发溶剂得到纯净![]() 固体W3克
固体W3克
问题:
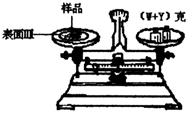
(1)调整天平零点时,若指针偏向左边,应将左边的螺丝帽向(填左、右) 旋转。
(2)某学生用已知质量Y克的表面皿,准确称取W克样品,他在托盘天平的右盘上放入(W+Y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边(如图所示),这时样品的实际质量m (填>,<,=)W。
(3)加入的试剂A是 ,B是 ,C是 。
(4)检验步骤④中A是否过量的方法是 。
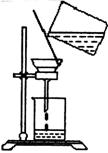 (5)过滤时,某学生的操作如图,明显的错误有 处。
(5)过滤时,某学生的操作如图,明显的错误有 处。
(6)两次洗涤沉淀,为了检验沉淀是否洗净,应在最后几滴洗出液中加入 ,若 表示沉淀已洗净。
(7)该粗盐中![]() 的质量分数的计算式是
的质量分数的计算式是
。
16、(13分)含氮废水进入水体而对环境造成的污染越来越严重,某课外兴趣小组先测定某废水中含NO3-为3×10-4mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关反应的离子方程式:
NO3-+ Al+ H2O→ N2↑+ Al(OH)3↓+ OH-
(2)上述反应中,还原剂是________,被还原的元素是___________,每生成2molN2,将有_______mol电子发生转移。
(3)有上述废水100m3,若要完全消除污染,则所耗金属铝的质量为________kg。(需要有过程)
08届高三化学第一次联考
答 题 卷
一、选择题(本题共12个小题,每小题4分,共48分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
13、(12分)一定存在的离子是 ;
可能存在的离子是 ;一定不存在的离子是 。
14、(15分) A ;B ;C ;
D ;E 。
15、(20分)
(1) (2)
(3)加入的试剂A是 ,B是 ,C是 。
(4) 。
(5)
(6) , 。
(7)
。
16、(13分)
(1) NO3-+ Al+ H2O→ N2↑+ Al(OH)3↓+ OH-
(2) , , 。
(3)金属铝的质量为________kg。计算过程:
08届高三化学第一次联考
参考答案
一、选择题(本题共12个小题,每小题4分,共48分。每小题只有一个选项符合题意)
1、A 2、A 3、C 4、B 5、A 6、B 7、A 8、C 9、D 10、B 11、D 12、D
13、(12分)一定存在NH4+ 、K+ 、CO32-、SO42- ;
可能存在Cl-; 一定不存在Ba2+、Mg2+(每空4分)
14、(15分)Na2CO3 Ba(OH)2 Mg(HCO3)2 AlCl3 Fe2(SO4)3(每空3分)
15、(20分) (每空2分)
(1)右 (2)<
(3)NaOH溶液 Na2CO3溶液 盐酸
(4)用玻璃棒蘸取试液点在红色石蕊试纸上,试纸变蓝,则加入A过量。
(5)2
(6)AgNO3溶液 无沉淀产生
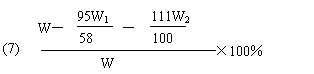 |
16、(13分) (1)6、10、18、3、10、6;(3分)
(2)Al (2分) N(2分) 20(2分)
(3)1.35;(4分)
n(NO3-)==3×10-4mol/L×l00×1000L==30mol,n(Al)==50mol。