08届高三年级化学第三次质量检测试题
化 学 试 题
命题人:高海峰 审核人:朱克勤
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,满分120分。考试时间100分钟。
可能用到的相对原子质量:Hg-201 C-12 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 K-39 Fe-56 Cu-64 Mn-55 Ag-108
第I卷(选择题 共56分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.2007年据世界卫生组织统计,最常用避孕环是含金属铜的。金属铜的避孕机理之一是:铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
2.下列物质中,能够导电的是
A.CO2 B.稀H2SO4 C.CuSO4·5H2O D.蔗糖
3.根据物质的分类推断下列反应类型关系正确的是
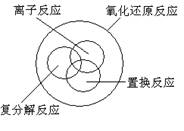
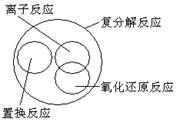
A B.
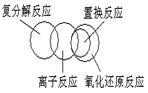 .
. 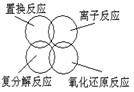
C D
4.关于胶体和溶液的区别,下列叙述中正确的是
(1)溶液呈电中性,胶体带有电荷
(2)溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷
(3)通电后,溶液中溶质微粒分别向两极移动,胶体中分散质微粒向某一极移动
(4)溶液中溶质微粒的运动有规律,而胶体中分散质微粒的运动是没有规律的
(5)溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光带
(6)溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
A.(1)(2)(5) B.(2)(3)(5) C.(4)(5)(6) D.只有(5)
5.下列性质不能用金属键理论解释的是
A.导电性 B.导热性 C.延展性 D.锈蚀性
6.向2mL0.5mol/L的FeCl3溶液中加入3mL5mol/L的KF溶液,发现FeCl3溶液渐渐褪至无色,再加入KI溶液和CCl4振荡后,静置,不见CCl4层有紫红色,则下列说法正确的是
A.Fe3+不与I—发生反应 B.Fe3+与F—结合成不与I—反应的物质
C.F—使I—的还原性减弱 D.Fe3+被F—还原为Fe2+,使溶液中不再存在Fe3+
7.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
8.想一想,次氯酸、稀硝酸、浓硫酸三种酸为什么可归为一类?与它们同为一类的酸是
A.盐酸 B.稀硫酸 C.浓磷酸 D.浓硝酸
二、不定项选择题(本题包括8小题,每题4分,共32分。每小题有一个或两个选项符)
9.有一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色,再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液中可能大量共存的一组离子是 ( )
A.K+、H+、NO![]() 、Na+ B.H+、Br-、SO
、Na+ B.H+、Br-、SO![]() 、Na+
、Na+
C.SO![]() 、Br-、OH-、Fe3+ D.H+、Br-、SO
、Br-、OH-、Fe3+ D.H+、Br-、SO![]() 、K+
、K+
10.实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu。以下有关说法正确的是
A.上述反应的产物Cu2HgI4中,Hg的化合价为+2
B.上述反应中CuI既是氧化剂,又是还原剂
C.上述反应中Hg与Cu均发生氧化反应
D.上述反应中生成 64g Cu时,转移的电子数为2×6.02×1023
11.下列变化,需加入还原剂才能实现的是( )
A.Br-→Br2 B.NO2-→NO C.ClO3-→Cl- D.Fe→Fe3O4
12.在充有空气压强为101kPa的密闭容器中装有HgO和2.3g金属钠,将其加热至500K(HgO受热分解成汞和氧气),使其充分反应,再冷却至室温,若容器内的气体成分未变,那么装入容器中的HgO可能是
A.28.06g B.21.70g C.10.83g D.1.60g
13.将Ba(OH)2溶液滴入混有盐酸的MgSO4溶液中,下列曲线不可能的是(纵坐标表示沉淀的量横坐标表示氢氧化钡溶液的体积)
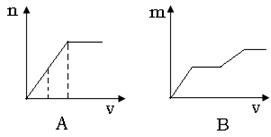
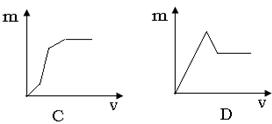
14.下列离子方程式中,正确的是
A.氧化钠投入水中:O2- +H2O== 2OH-
B.在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2+ + SO42- == BaSO4↓
C.氯气通入水中:Cl2 + H2O== Cl- + ClO- + 2H+
D.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
15.X、Y、Z是原子序数依次递增的三种短周期元素。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。则下列说法一定正确的是
A.其中有硫元素 B.其中有金属元素
C.这三种元素能够组成盐 D.这三种元素均位于不同周期
16.用NA表示阿伏加德罗常数,下列说法正确的是
A.在反应2Sb2S3+3O2+6Fe=Sb4O6+6FeS中每生成3 mol FeS时,共转移3mol电子
B.0.5 mol I-被氧化时失去的电子数为0.5NA
C.过氧化钠与水反应时,每有两个-1价的氧被氧化,必有两个-1价的氧被还原。
D.常温常压下,48 g O3含有氧原子数为3NA

|
三、(本题包括2小题)
17.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应产生①I03-+5I-+6H+=3I2+3H20
②3I2+3HS03-+3H20=6I-+3HS04-+6H+
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象。
(1)在KIO3中碘元素的化合价是________,在反应②中还原剂是_______。
(2)在整个反应过程中,起催化作用的物质是_______,
写出总的离子方程式____ ______。
(3)上述两个反应中,反应速率较快的是________(填序号)。
(4)请解释溶液颜色迅速变蓝、又很快消失的原因____ _______.
18.某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
⑴在实验①中,下图所示的操作中正确的是_______________(填代号)

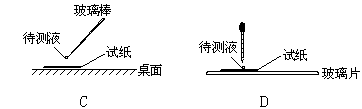
⑵根据上述实验判断原溶液中肯定存在的离子是___________________,
肯定不存在的离子是___________________
⑶写出与②③三个实验有关的离子方程式:
②: ___ ___________ ___________ ________ ;
③: ___ ___________ _______ ____________ ;
19.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中.的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ,G ;
(2)D的前一元素第一电离能高于D的原因: ;
(3)由A、B、C形成的ABC分子中,含有 个σ键, 个π键;
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是
(写化学式),原因是 ;
四、(本题共有1小题)
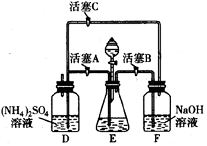 20.莫尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用右图所示的实验装置来制取莫尔盐,实验步骤如下:
20.莫尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用右图所示的实验装置来制取莫尔盐,实验步骤如下:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离,将分离出的NaOH溶液装入F中;
②在E中用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合,结晶得到莫尔盐。
试回答下列问题:
(1)利用铁屑和稀硫酸反应产生的氢气赶走装置中的氧气及硫酸铵溶液中溶解的氧,其目的是_________________________________;铁屑和稀硫酸反应产生的氢气的另外一个作用是_______________________________________________。
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
___________________________________________________________________。
(3)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。若取产品24.50g配成100mL溶液,取出10mL用0.10mol·L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL。
①试配平反应的离子方程式:
______MnO![]() +_____Fe2++_____H+=_____Fe3++______Mn2++
+_____Fe2++_____H+=_____Fe3++______Mn2++
②试求产品中莫尔盐的质量分数_______________ (NH4)2SO4·FeSO4·6H2O的相对分子质量为392)。
五.(本题共2小题)
21.甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
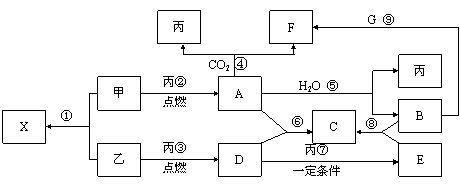
请回答:
(1) 写化学式:丙_________,E________。
(2)X的电子式为____________________。
(3) 写出A与H2O反应的化学反应方程式:__________________________ 。
(4) 写出B与G溶液反应生成F的离子方程式:________________________。
(5) 在上图的反应中,不属于氧化还原反应的是(填序号)______________。
22.阅读下面两条科普信息,回答问题:
ⅰ)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收。
ⅱ)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。回答下列问题:
(1)服用维生素C,可以使食物中的Fe3+还原成Fe2+,这说明维生素C具有 性。
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为: 。
(3)第ⅱ)条信息中的CO2做 剂,写出第ⅱ)条信息中的离子方程式 。
六、(本题共1小题)
23.含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—
(1)现在要除去1m3含氮元素0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝__________g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_____________________________。
②已知金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水多少kg?