08届高三年级理综化学第二次周考试题
理科综合能力测试
6.“神舟”系列所用动力燃料之一为氢化锂三兄弟—-LiH、 LiD、 LiT。 其中Li的质量数为7,下列叙述中正确的是( )
A、三种物质质子数之比为1:2:3 B、三种物质中子数之比为1:1:1
C、三种物质的摩尔质量之比为8:9:10 D、三种物质的化学性质不相同
7.在我们现行的教科书中的以下几个化学实验:a.中和热的测定b.浓硫酸跟乙醇反应制乙烯;c.乙醛还原新制的氢氧化铜;d.乙酸乙酯的制取;e.石油的蒸馏;f.葡萄糖的银镜反应;g.乙酸乙酯的水解。以上实验需用水浴加热的是
A、acd B、fg C、aef D、cefg
8.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是 ( )
A、常温条件下,酚酞的变色范围:![]()
B、HCl和NaAlO2溶液反应后铝元素的存在形式:
![]()
C、CO2通入澄清石灰水中反应的产物:![]()
D、分散系的分类:![]()
9.某同学按图所示的装置进行电解实验。下列说法正确的是( )
A、电解过程中,铜电极上有H2产生
B、电解初期,主反应方程式为:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑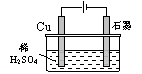
C、电解一定时间后,石墨电极上才有氧气析出
D、整个电解过程中,H+的浓度不断增大
10.25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,正确的是
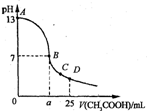 A、B点的横坐标a=12.5
A、B点的横坐标a=12.5
B、C点时c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
D、曲线上任一点,溶液中都是:
c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
11.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3 + Cu = 2FeCl2 + CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铁、铜都无 D、烧杯中铁、铜都有
12.下列反应的离子方程式正确的是
A.亚硫酸钠溶液中加入硝酸:SO32-+ 2H+ = H2O + SO2↑
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3↑+2H2O
| |
D.苯酚钠溶液中通入过量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO 32-
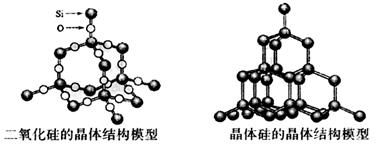
13.化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,△H的值为
| 化学键 | Si—O | O==O | Si—Si | Si—Cl | Si—C |
| 键能kJ·mol-1 | 460 | 498.8 | 176 | 360 | 347 |
|
A.+989.2 kJ·mol-1 B.-61.2 kJ·mol-1 C.-989.2 kJ·mol-1 D.-245.2 kJ·mol-1
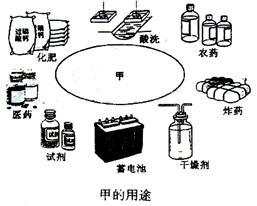
26.(15分)a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示。a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种。化合物甲、乙、丙、丁、戊之间也能相互反应。已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物。若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)
|
试解答下列问题:
(1)写出甲的化学式 丁的电子式
(2)写出反应③的化学方程式:
(3)乙的结构式是 ;实验测得化合物乙和化合物戊能以任意比相溶,根据“相似相溶”的经验规律可推测化合物乙是 分子(填“极性”或“非极性”)。
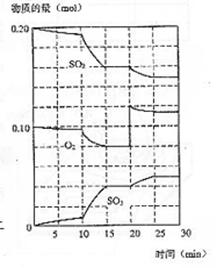 27(15分).在一定条件下,二氧化硫与氧气发生如下反应:
27(15分).在一定条件下,二氧化硫与氧气发生如下反应:
![]() 2SO2(g)+ O2
(g) 2SO3(g) (△H <0)
2SO2(g)+ O2
(g) 2SO3(g) (△H <0)
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因是(用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
28(15分).化合物A是含有2种官能团且式量等于为60的有机物。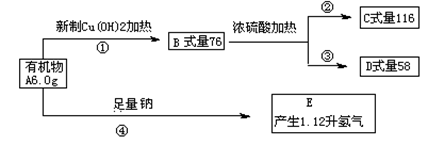
(1)写出A、D的结构简式 、 。B分子含有的官能团名称
(2)写出②的化学方程式 ,其反应类型
(3) B在一定条件下亦可生成一类高分子化合物,其化学方程式为 , 若1吨此类材料完全燃烧耗氧气 吨
29(15分).实验室可以通过三条途径按不同要求来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热NaNO2(一种致癌物质)与NH4Cl的混合浓溶液制取N2。
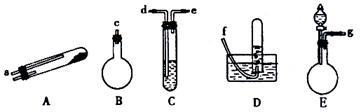
如图所示,给出了按上述途径制N2的可供选择的几种实验仪器,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
|
(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,最好要用上述仪器中的 (填仪器代码,下同)作为氨气发生装置,该制取原理是(用化学方程式说明) 。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的 (按气流从左到右的顺序列出)。
(2)按途径②制取N2,原料气空气是通过向 (填上述仪器代码)中加入
而送入反应器的。
(3)上述三种制取N2的途径,①和②两条途径常常被协同使用而越来越受到人们的关注,这种方法与途径③相比其优越性在于 。