08届高三毕业班化学第三次月考试题
化学科试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Ca-40 Al-27
Fe-56 S-32 Cl-35.5 Na-23 F-19 Mg-24
第Ⅰ卷(选择题,共70分)
一.选择题(本题包括10小题,每小题3分,共30分。每小题只有1个选项符合题意)
1.下列叙述正确的是:
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
2.已知25℃、10lkPa条件下:
4Al(s)+3O2(g)=2Al2O3(s) △H=-2834.9kJ·mol-1;
4Al(s)+2O3(g)=2Al2O3(s) △H=-3119.1kJ·mol-1 由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
3.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.相同质量的N4和N2所含原子个数比为2:1
C.N4是N2的同位素 D.N4的沸点比N2高,N4的化学性质比N2更稳定
4.(07年高考上海) ![]() 是重要的核工业原料,在自然界的丰度很低。
是重要的核工业原料,在自然界的丰度很低。![]() 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关![]() 说法正确的是
说法正确的是
A.![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B.![]() 原子核外有143个电子
原子核外有143个电子
C.![]() 与
与![]() 互为同位素 D.
互为同位素 D.![]() 与
与![]() 互为同素异形体
互为同素异形体
5.(07年高考江苏)下列叙述正确的是
A.原子晶体中的相邻原子间只存在非极性共价键
B.6Li和7Li的电子数相等,中子数也相等
C.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
D.Ar原子的结构示意图为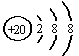
6.(07年理综北京)X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A、X的原子半径一定大于Y的原子半径
B、X与Y的简单离子不可能具有相同的电子层结构
C、两元素形成的化合物中,原子个数比不可能为1:1
D、X2Y可能是离子化合物,也可能是共价化合物
7.下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3 S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(g) △H5 2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)=Ca(OH)2(s) △H8
A ②③④ B ④ C ① D ①②③
8.离子键、共价键、和范德华力是构成物粒子之间的不同作用力。下列物质中只含有上述一种作用力的是
A、冰 B、氯化钠 C、氢氧化钠 D、碘
9.下列性质能证明某化合物内一定存在离子键的是
A、可溶于水 B、水溶液能导电 C、具有较高的熔点 D、熔融状态下能导电
10.(07年理综山东)关于元素的叙述正确的是
A、金属元素与非金属元素不能形成共价化合物
B、目前使用的元素周期表中,最长的周期含有32种元素
C、只有在原子中,质子数才与核外电子数相等
D、非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项,只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
11.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C2->D->B+>A2+ D.单质的还原性 B>A>C>D
12.(07江苏)有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2
D.若Y的最高正价为+ m,则X的最高正价一定为+ m
13.(04上海)有关晶体的下列说法中正确的是
A、晶体中分子间作用力越大,分子越稳定
B、原子晶体中共价键越强,熔点越高
C、冰融化时水分子中共价键发生断裂
D、氯化钠熔化时离子键被破坏
14.(2005年广东)NA为阿伏加德罗常数,下列说法正确的是
A、常温常压下,16g甲烷所含有的电子数目为10NA
B、常温常压下,4g氦气所含有的中子数目为4NA
C、标准状况下,22.4L单质溴所含有的原子数目为2NA
D、电解食盐水若产生2g氢气,则转移的电子数目为2NA
15.(2004上海)下列离子方程式中正确的是
A.硫化亚铁放入盐酸中 S2-+2H+=H2S↑
B.硫酸铜溶液中通入硫化氢 Cu2++H2S=CuS↓+2H+
C.氯化铝溶液中加入过量氨水 Al3++4NH3•H2O=AlO2-+ 4NH4++2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O
16. 下列各种环境下的离子组合能够大量共存的是
A.中性溶液中:Mg2+、Fe3+、SO32-、I-
B.pH=0的溶液中:Al3+、NH4+、Ca2+、ClO-
C.c(H+)=10―14mol·L―1的溶液中:Na+、AlO2-、S2-、SO42-
D.使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3-
![]() 17.下列各组物质中不能按图
(“→”表示一步完成)关系转化的是
17.下列各组物质中不能按图
(“→”表示一步完成)关系转化的是
| a | b | C | |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | S | SO2 | SO3 |
| D | Al(OH)3 | NaAlO2 | A12O3 |
18.类推的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,因此类推出的结论最终要经过实践的检验才能确定是否正确。以下几种类推结论中正确的是
A.CaCO3的溶解度小于Ca(HCO3)2,推出Na2CO3溶解度小于NaHCO3
B.NH3的沸点高于PH3,推出CH4沸点高于SiH4
C.H2SO4为强酸,推出HClO4为强酸
D.碳的+4价化合物稳定,推出硅的+4价化合物稳定
19.下列各组中的两物质相互作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.AlCl3和NaOH
20.超临界流体(Supercritical Fluid)是温度和压力同时高于临界值的流体,也即压缩到具有接近液体密度的气体,是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在中药、香料的萃取分离以及作为溶剂、发泡剂取代氟利昂等具有重要价值。下列有关说法中错误的是
A、超临界二氧化碳与CO2的物理性质不同,化学性质相同
B、超临界二氧化碳可能是一种原子晶体
C、用超临界二氧化碳溶解萃取物质,符合绿色化学的思想
D、用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
第II卷(非选择题,共80分)
三、(本题包括3小题,共23分)
21(6分)下列有关实验的叙述,不正确的是(填序号) 。
①蒸干FeCl3溶液可以得到无水的氯化铁
②在氢氧化铁胶体中加少量硫酸会产生沉淀
③无法用分液漏斗将甘油和水的混合物分离
④用干燥洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,试纸完全变色后,跟标准比色卡比较
⑤滴定时左手控制滴定管,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
⑥硝酸、溴水不可以长期盛放在棕色滴瓶中
22(9分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种粒子(离子或分子)。请回答:
⑴A元素是 、B元素是 、C元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的粒子中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
23(8分)下表是元素周期表中短周期元素部分,表中字母分别代表一种元素:
| a | b | ||||||
| d | e | f | |||||
| c | g | h | |||||
(1)上述 元素(填字母代号)可以形成硬度最大的单质。
(2)“神舟”六号飞船内需要有一种化合物来吸收宇航员呼出的CO2,你认为该物质应该是由上表中的 和 元素(填字母代号)组成的,写出该化合物与CO2反应的化学方程式 。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气体用于稀释氧气,该气体分子的结构式是 。
(3)表中元素g的氢化物热稳定性比元素e的氢化物的热稳定性 (填“强”或“弱”)。
四(本题包括2小题,共28分)
24(07年高考理综重庆)(14分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1) e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)______________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为______________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)______________________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
25(07年高考上海)(14分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该粒子的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是___________。
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
五、(本题包括2小题,共19分)
26(8分)火箭的主要燃料是“偏二甲肼”,已知该化合物由C.H、N三种元素组成, WC=40%,WH=13.33%,其相对分子质量为60。通过结构分析可知,该物质分子中有一个氮原子以![]() 存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2,5.00g“偏二甲胼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2,5.00g“偏二甲胼”完全燃烧时可放出212.5kJ热量。
(1)试推算“偏二甲肼”的分子式,并写出它的结构简式。
(2)写出燃料燃烧的热化学方程式并指出其优点。
27(11分)X、Y、Z是短周期元素的三种常见非金属,它们均存在同素异形体。三种单质两两化合均能形成原子个数为1∶2的化合物,X与Y能形成一种非极性溶剂,Y的原子序数大于X,Z的一种单质是医疗中常用的急救物品。
⑴写出三种元素的符号:X___________,Y___________,Z___________。Y元素在周期表中的位置是________________。
⑵若X与Y形成的化合物是甲,则甲的电子式为______________________;当1g液态甲完全燃烧放出QkJ热量,则甲燃烧的热化学方程式为______________________。
⑶比较Y和Z的氢化物的沸点高低______________________(用物质的化学式表示)。
六(本题10分)(27、28题为任选题,考生可任选一题来做)
28(10分)某化学兴趣小组的同学买来一瓶“84”消毒液,请大家与他们一同来研讨以下问题:
(1)此瓶“84”消毒液的说明书上这样写道:“本品为无色液体,呈碱性……”,
①请推测它的有效成分_____________
A.Cl2 B.H2O2 C.NaClO D.KMnO4
②请用离子方程式表示此“84”消毒液呈碱性的原因是______________________。
(2)该化学兴趣小组的同学分别在瓷碗和铁锅中盛放20 mL的“84”消毒液,露置在阳光充足的室内。
他们首先对瓷碗中盛放的消毒液的消毒效果和组成成分的变化进行了研究。所得数据图如下
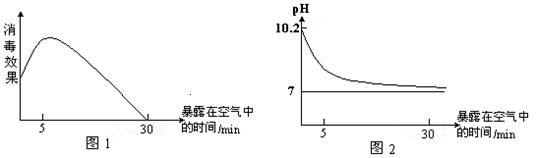
对比数据图1和2得到的结论有:消毒液暴露在空气中,随着时间的推移,它的消毒效果______________,溶液的碱性_______________________________________________;
(3)该化学实验小组同学上网查询有关“84”消毒液的信息时,发现这样一则消息:有一家庭主妇把抗SARS用的”84“消毒液和清洁剂(呈酸性、含Cl-)都倒出一些混合在一起,进行刷洗。一会儿,她就晕倒在房间里。这几位同学感到迷惑不解。请你用离子方程式帮助他们解开这一悬念:_________________________________________________。
(4) 实验小组同学通过本次探究性学习,感到收获颇多,同时了解到商品说明书
的重要性。请你根据以上事实将下列“84”消毒液的说明书补充完整
| 有效成分 |
|
| 主要用途 | 1.可对餐具、瓜果、衣物及环境进行消毒 2.可漂白浅色衣物 |
| 注意事项 | 1.对带色衣物和丝毛织品易脱色、变黄 2.原液如接触皮肤,用清水冲洗即可 3.原液对金属易腐蚀 4.______________________________ 5.______________________________贮藏 |
| 保质期 | 有效期10个月,一段时间后,药量应增加使用 |
29(10分)21世纪是全世界大规模开发利用海洋资源、发展海洋经济的新时期。为了人类和平利用海洋资源,今年我国环球科学考察船“大洋一号”首次执行环球大洋科学考察任务。海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。该反应的化学方程式为:
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法流程如下:
![]()

写出
②反应的离子方程式: ;
④反应的化学方程式 。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A.皂化反应 B. 与金属钠反应 C. 氧化反应 D. 加成反应
08届高三第三次月考化学试题答案及评分标准
选择题答题卡(共70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | A | C | C | D | A | B | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | CD | AC | BD | AD | B | C | D | CD | C | B |
21. ①④⑤ (每对一个得2分,错一个倒扣2分)
22.(1)K Cl S (2)HCl
(3)F2 ‥
(4)H2S H:S:H
‥
(5)H2O2(答PH3同样给分)
(6)C2H6 (每空1分)
23、(1)d (2) c ; f (2分) 2CO2+2Na2O2 =2Na2CO3+O2 (3分) N≡N
(3)弱 (其它每空1分)
24、(14分)(1)S。 (1分)
(2)CH4<NH3<H2O; 共价键和离子键; 离子晶体; ![]() 。(每空各2分)
。(每空各2分)
(3)CO32
-+H2O![]() HCO3-+OH-或C2O42 -+H2O
HCO3-+OH-或C2O42 -+H2O![]() HC2O4-+OH-。(2分)(4)0.3 mol Na2O2、0.1 mol Na2CO3
(3分)
HC2O4-+OH-。(2分)(4)0.3 mol Na2O2、0.1 mol Na2CO3
(3分)
25、(14分)(1)6; ![]() 。 (2) H
。 (2) H
‥ ‥
[H﹕N﹕H]+
‥ ‥
H
(3)Cl; b。 (4)H2CO3; 弱酸性或非氧化性酸(合理即给分)。(每空各2分)
26(1)分子式: C2H8N2 (2分) 结构简式:![]() (2分)
(2分)
(2)热化学方程式为:(3分)
C2H8N2(l)+2N2O4(l)=2CO2(g)+4H2O(g)+3N2(g) △H =―2250 kJ·mol―1
燃烧产物无污染。(1分)
27 ⑴X:C Y:S Z:O(3分) 第三周期,VIA族 (2分)
⑵:S::C::S: (2分) CS2(l)+3O2(g)![]() CO2(g)+2SO2(g) △H=-76QkJ/mol(3分)
CO2(g)+2SO2(g) △H=-76QkJ/mol(3分)
⑶H2O>H2S(1分)
28(1)①C (1分)
②ClO- + H2O ![]() HClO +OH-
(2分)
HClO +OH-
(2分)
(2)
先增强后减弱;(1分)先减弱较快后减弱缓慢,且半小时后溶液逐渐接近中性;(1分)
(3)2H+ + Cl- + ClO- = Cl2↑+ H2O (2分)
(4)NaClO (1分)
不能与酸性(含Cl-)洗涤剂同时使用 (1分)
避光、避热、密封 (1分)
29(1)IA (2)物理变化 (以上每空各1分)
(3)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(4)OH-+SO2=HSO3- NaHSO3+HCl=NaCl+H2O+SO2↑
(5)BC
(以上每空各2分)