08届高三化学上学期第四次摸底考试
1. 据人民网报道:在太空中发现迄今已知最大钻石 直径4000公里,重达100亿万亿万亿克拉。下列关于金刚石的叙述说法正确的是:
A.含1molC的金刚石中的共价键为4mol
B.金刚石和石墨是同分异构体
C.C(石墨) C(金刚石) ;△H=+1.9KJ/mol,说明金刚石比石墨稳定
C(金刚石) ;△H=+1.9KJ/mol,说明金刚石比石墨稳定
D.石墨转化为金刚石是化学变化
 2. 2007年12月16日 为期两周的联合国气候变化会议在延长一天会期之后于星期六在印尼巴厘岛闭幕。会议在经过激烈的谈判后通过了巴厘岛路线图,决定启动至关重要的有关加强应对气候变化问题的谈判。为人类生存环境创造好的条件。下面关于环境的说法正确的是
2. 2007年12月16日 为期两周的联合国气候变化会议在延长一天会期之后于星期六在印尼巴厘岛闭幕。会议在经过激烈的谈判后通过了巴厘岛路线图,决定启动至关重要的有关加强应对气候变化问题的谈判。为人类生存环境创造好的条件。下面关于环境的说法正确的是
A.地球上的碳是不断地循环着的,所以大气中的CO2含量不会改变
B.燃烧含硫的物质导致酸雨的形成
C.生活中臭氧的含量越高对人越有利
D.气候变暖只是偶然的因素
3. 2007年11月26日,我国首次月球探测工程第一幅月面图像发布。月球的月壤中含有丰富的3He,月海玄武岩中蕴藏着丰富的钛、铁、铬、镍、钠、镁、硅、铜等金属矿产资源和大量的二氧化硅、硫化物等。将为人类社会的可持续发展出贡献。下列叙述错误的是
A、二氧化硅的分子由一个硅原子和两个氧原子构成
B、不锈钢是指含铬、镍的铁合金
C、3He和4He互为同位素
D、月球上的资源应该属于全人类的
4.金属铜的提炼多从黄铜矿开始。黄铜矿在燃烧过程中主要反应之一的化学方程式为:2CuFeS2+O2=====Cu2S+2FeS+SO2,下列说法不正确的是
A.O2只做氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1molO2参加反应,则有4mol电子转移
5.4℃时,25滴水为amL,则1滴水中含有的水分子数为
A.aNA/25 B.aNA/(25×18) C.aNA/(25×20) D.aNA/(1000×22.4)
6.下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
7.下列各项中的两个量,其比值一定为2:1的是
A.在反应2FeCl3+Fe====3FeCl2中还原产物与氧化产物的质量
B.在相同温度下,0.2mol·L-1CH3COOH溶液与0.1mol·L-1CH3COOH 溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达到平衡c(NH3)和c(N2)
2NH3已达到平衡c(NH3)和c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积
8.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中电离过程为:
OH OH
| |
HO—B+H2O ![]() [HO—B—OH]-+H+
[HO—B—OH]-+H+
| |
OH OH
下列判断正确的是
A.凡是酸或碱对水的电离都是抑制的 B.硼酸是三元酸
C.硼酸溶液与NaOH溶液反应的离子方程式:H3BO3+OH-====[B(OH)4]-
D.硼酸是两性化合物
9.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有③④正确 D.①②③④均不正确
10.已知CuSO4溶液分别与Na2CO3溶液,Na2S溶液的反应情况如下:
(1)CuSO4溶液和Na2CO3溶液
主要:Cu2++CO32-+H2O=====Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=====CuCO3↓
(2)CuSO4溶液和Na2S溶液
主要:Cu2++S2-====CuS↓
次要:Cu2++S2-+H2O====Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3 B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2>CuCO3>CuS
11. 某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Cu2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.K+、NO![]() 、SO
、SO![]() 、H+、Na+
D. MnO
、H+、Na+
D. MnO![]() 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO![]()
12. 下列实验操作会引起测定结果偏高的是
A.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却
B.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
C.读取量筒中一定体积的液体时,俯视读数
D.配制物质的量浓度的溶液,定容时仰视刻度线,所配溶液的浓度
| ||||||||||||||||
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
14. 反应 aX(g) + bY(g) ![]() cZ(g);△H = QKJ/mol,有下图所示关系,下列判断中正确的是
cZ(g);△H = QKJ/mol,有下图所示关系,下列判断中正确的是
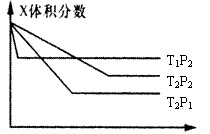 A.a
+b>c,Q<0
A.a
+b>c,Q<0
B.a +b>c,Q>0
C.a +b<c,Q<0
D.a +b<c,Q>0
15.三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 + V2 +V3的容积中后,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是
A.3∶7∶4 B.5∶7∶6 C.7∶3∶6 D.1∶1∶1
第四次摸底考试
命题人 刘焕山
可能用到的相当原子质量:H—1 O—16 C—12 N—14 S—32
Cl—35.5 Na—23 Ca—40 Fe—56
一、选择题(共15小题,每题只有1个正确答案,每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
二、(共55分)
16.(5分)下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是 (填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是 (填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
17.(10分)
【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。
实验装置和现象如图所示。请你一起参与。
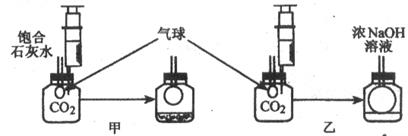
|
【现象结论】甲装置中产生该实验现象的化学方程式为 。
解释通常用石灰水而不用NaOH溶液检验CO2的原因
;乙装置中的实验现象是 。
吸收CO2较多的装置是 。
【计算验证】另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为通过吸收CO2应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:
。
 18.(12分)下面是关于硫化氢的部分文献资料
18.(12分)下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
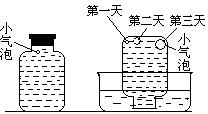
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
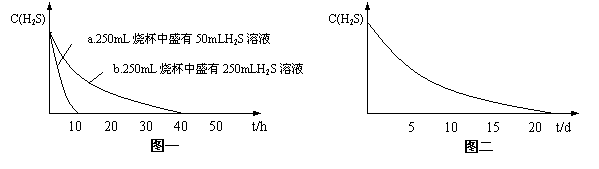
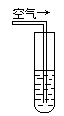 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
 实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应_____ __
___ _______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
19.(10分)已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示
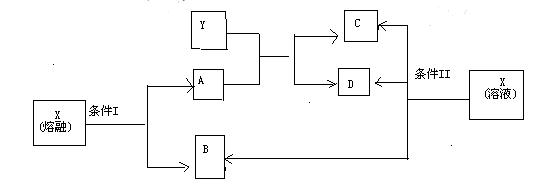
(1)已知条件I和条件II相同,则该反应条件为
(2)物质X的电子式为
(3)写出B与Ca(OH)2反应的化学方程式
(4)写出X在条件II下反应生成B、C、D的离子方程式
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目
(6)请简述鉴定物质X的实验方法
20.(10分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
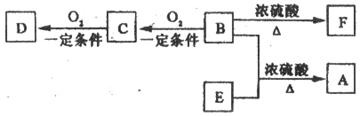
①B分子中没有支链
②D能与碳酸氢钠溶液反应放出二氧化碳
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 、
、 、 。(可不填满,也可补充)
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:
。
21.(8分) 将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是______________;
②原硝酸溶液的物质的量浓度为:________________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
第四次摸底考试答案
一、选择题(共15小题,每题只有1个正确答案,每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | B | A | D | B | C | A | C | D | A | C | C | C | A | B |
二、共55分
16.(5分)(1)a、b、c (2)B (3)9.5g
17.(10分 每空2分)
CO2+Ca(OH)2=CaCO3↓+H2O(CO2适量)CO2和石灰水作用有明显的现象,和NaOH作用无明显现象; 气球体积增大,溶液不变浑浊。 乙 因为Ca(OH)2的溶解度较小,所形成的饱和石灰水中溶质的质量分数很小。
18.(12分)
(1)硫化氢的挥发(1分)。
(2)H2S+I2==2HI+S↓(1分)向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色(2分)。
(3)S或硫(2分)。
(4)氢硫酸被空气中氧气氧化(1分);防止因通入空气过快而使硫化氢大量挥发(2分)。
(5)硫化氢自身分解(1分);确证生成的气体是氢气(2分)。
19.(10分)(1)电解(1分)
(2)![]() (1分)
(1分)
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(1分)
|
(4)2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分)
2e-
(5)MnO2+4HCl MnCl2+2H2O+Cl2↑(用双线桥表示也可)(2分)
(6)用焰色反应检验Na+;(1分)用硝酸银和稀硝酸检验Cl-(1分)
19.(10分)(1)①②④ (2)羧基 碳碳双键
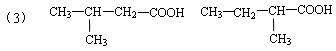
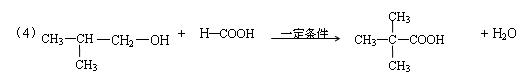
22.(8分)⑴ ①Fe(NO3)2 ② 0.8 ⑵ ①FeSO4 ② 5.0