08届高三化学第一学年期末模拟考试试题
(3)
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列关于蛋白质的叙述中,不正确的是 ( )
A.蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解
B.人工合成具有生命活力的蛋白质—结晶牛胰岛素是我国科学家1965年首次合成的
C.重金属盐能使蛋白质凝结,所以误食重金属盐会中毒
D.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生颜色反应
2.下列实验操作会导致实验结果偏高的是 ( )
A.用NaOH标准液测定未知浓度的盐酸时,滴定后滴定管尖嘴部分存在一段空气
B.测定中和热实验中,两只烧杯口不相平
C.测定硫酸铜晶体结晶水含量的实验中,加热分解后的样品置于空气中自然冷却
D.配制0.1 mol·L-1 NaCl溶液时,定容时俯视刻度线
3.物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是 ( )
A.常温下,“纳米铜”与铜片的还原性相同; B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”比铜片的金属性强; D.常温下,“纳米铜”比铜片的氧化性强
4.下列各组物质中不易用物理性质区分的是 ( )
A.苯和四氯化碳 B.酒精和汽油
C.碘和高锰酸钾固体 D.氯化铵和硝酸铵晶体
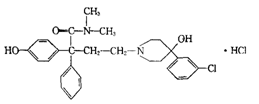 5.盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图: 下列说法不正确的是
( )
5.盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图: 下列说法不正确的是
( )
A.易蒙停的分子式为C29H34Cl2N2O3
B.向易蒙停溶液中加入FeCl3溶液,溶液显紫色
C.1mol易蒙停只能与lmolNaOH发生反应
D.lmol易蒙停最多能与3mol溴水发生反应
6.下图是2008奥运吉祥物,其外材料为纯羊毛,内充聚酯纤维,该聚酯纤维的化学式为 (COC6H4COOCH2CH2O)n。下列说法中不正确的是 ( )





A.羊毛与聚酯纤维的化学成分不相同 B.由单体合成聚酯纤维的反应属加聚反应
C.该聚酯纤维单体为对苯二甲酸和乙二醇 D.聚酯纤维和羊毛一定条件下均能水解
7.某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是 ( )
①分子具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃
③分子中具有12个氢原子的烷烃 ④分子中具有8个碳原子的烷烃
A.①② B.②③ C.③④ D.②④
8.将a mol纯铁粉投入含HNO3 b mol的稀溶液里,恰好完全反应并放出NO气体,则a和b的关系是 ( )
A.a/b=1/4 B.a/b=3/8
C.1/4≤a/b≤3/8 D.a/b的值无法确定
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意)
9.下列离子方程式不正确的是 ( )
A.100mL0.1mol·L-1的Na2CO3溶液中加入0.01molCH3COOH
CO32—+ 2CH3COOH = CO2↑+ 2CH3COO—+ H2O
B.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl等体积互相均匀混合
4AlO2—+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色
5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4— + 2H2O
D.甲醛溶液中加入足量的银氨溶液并加热
HCHO+2[Ag
(NH3)2]++2OH—![]() HCOO—+NH4++2Ag↓+3NH3+H2O
HCOO—+NH4++2Ag↓+3NH3+H2O
10.设NA为阿伏加德罗常数,下列叙述合理的是 ( )
A.通常状况下,1molNaHCO3投入足量稀盐酸中,反应完后,可逸出NA个CO2分子
B.在含有1mol CH3COO—的醋酸钠溶液中, Na+数目略大于NA
C.46gNO2和N2O4混合气体中含有原子数为3NA
D.22.4L的O3和O2的混合气体所含原子数为3NA
11.有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是 ( )
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42
12.6.二○○八年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是
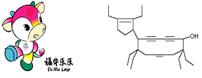 A.牛式二烯炔醇含有3种官能团
A.牛式二烯炔醇含有3种官能团
B.牛式二烯炔醇含有3个手性碳原子
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应
13.据最新报道,科学家发现了如下反应:O2 + PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是 ( )
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子
D.在O2(PtF6)中不存在共价键
14.有机物A和B只由C、H、O三种元素中的两种或三种组成,相等物质的量的A和B分别燃烧时,消耗相等物质的量的氧气。则A和B的相对分子质量的差值不可能是(n为小于5的正整数) ( )
A.44n B.18n C.14n D.0
第Ⅱ卷(非选择题,共72分)
三:(本题包括1小题,共8分)
15.(8分)(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试纸检验Cl2的性质 ;
②分液漏斗(分液) ;
(2)下列有关实验的叙述中,合理的是 ( 多选倒扣分)
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
四:(本题包括2小题,共16分)
16.(8分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分反应物或生成物没有列出)。其中,化合物石灰氮是由Ca、N、C等三种元素组成的盐,它以前是一种常用的肥料,其含钙、碳的质量分数分别为50%、15%。反应①是石灰氮的完全水解,其产物之一可方便地制成一种氮肥。通常状况下,C为气体。
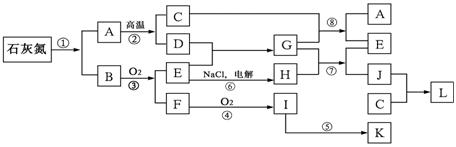 请按要求回答:
请按要求回答:
⑴写出石灰化氮的化学式 ______;
⑵写出反应①的化学方程式 ___________________________________;
⑶除反应②、③、④、⑤是应用于工业生产外,还有两个反应是运用于工业生产的反应,它们的化学方程式分别是 ____________和 _________。
 17.(8分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
17.(8分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(3)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
五:(本题包括2小题,共18分)
18.(8分)A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含有一种官能团,且每个碳原子上最多只连一个官能团:A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
⑴ A的分子式是 ,其结构简式是 。
⑵ 写出A与乙酸反应的化学方程式: 。
⑶ 写出所有满足下列3个条件的A的同分异构体的结构简式。①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是
______________________。
![]() 19.(10分)快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—“奖赏中心”给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺的结构为:
19.(10分)快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—“奖赏中心”给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺的结构为:
回答下列问题:
I、多巴胺的分子式为 。
II、写出多巴胺与浓溴水反应的化学方程式: 。
III、多巴胺可由香兰素与硝基甲烷反应后再经锌汞齐还原水解制得。合成过程可表示如下: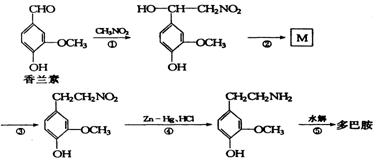
(1) 反应①属于 反应(填反应类型)。
(2)写出M的结构简式 。
 (3)多巴胺分子中羟基处于苯环上不同位置时的同分异构体共有 种(苯环上的其它结构不变)。
(3)多巴胺分子中羟基处于苯环上不同位置时的同分异构体共有 种(苯环上的其它结构不变)。
六:(本题包括2小题,共16分)
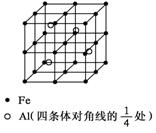
20.(6分)晶体是质点(分子、离子或原子等)在空间有规则地排列、具有整齐外形、以多面体出现的固体物质。在空间里无限地周期性的重复能形成晶体的、具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如下图所示。
请据此回答下列问题
(1)确定该合金的化学式____________。
(2) 取2.78 g的该合金粉末溶于100 mL某稀硝酸溶液中,待反应完全后得到1.12 L NO气体(标准状况,设两者恰好完全反应),则原硝酸溶液的物质的量浓度为______mol/L,反应后溶液中Fe3+离子的物质的量浓度为______mol/L。
21.(10分)I、几年前,科学家用NaNO3和Na2O在573 K反应制得了离子化合物Na3NO4。⑴ 经测定Na3NO4中的各原子的最外层电子都达到了8电子稳定结构,则NO43-的电子式为 。
⑵ Na3NO4与二氧化碳或水都能剧烈反应而转化为两种常见物质,试写出这两个反应的化学方程式: , 。
II、甲酸在浓硫酸作用下脱水可制得CO,碳酸可分解为H2O和CO2,目前已有文献报道,碳还能形成其他一些氧化物,如:丙二酸在减压下用P4O10于140℃脱水可制得C3O2,它的熔点—120℃,沸点6.7℃,室温下聚合成黄色液体。根据以上信息可推知:C3O2的结构简式为____________ ,C3O2是____________分子(填“极性”或“非极性”)
七:(本题包括1小题,共8分)
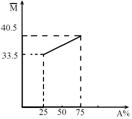 22.由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
22.由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
⑴A的相对分子质量为__________。
⑵若测得混合气体中仅含两种元素,
A、B都是无机物时,化学式分别为_________、________,
A、B都是有机物时,化学式分别为_________、________。
⑶某混合气由A、B等体积混合而成,将其与适量氧气混合,引燃后反应物均无剩余,将产物依次通过足量浓H2SO4(减少的体积恰好等于消耗氧气的体积)、足量碱石灰(体积减半),又知通过浓H2SO4与通过碱石灰所减少的气体体积之比为5∶2。气体体积均在105℃和1.01×105Pa条件下测定的,据此确定混合气体的组成为 。
八、(本题分A、B两题,考生只要选其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分)
23A.(物质结构与性质,12分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为 。
(3)写出D原子的核外电子排布式 _,C的氢化物比D的氢化物在水中溶解度大得多的可能原因 。
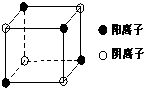 (4)右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为
,FeD2物质中具有的化学键类型为
。
(4)右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为
,FeD2物质中具有的化学键类型为
。
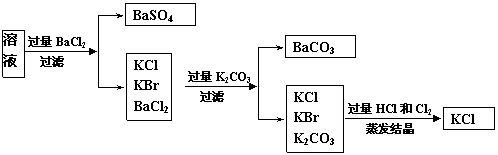
23B.(实验化学,12分)实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
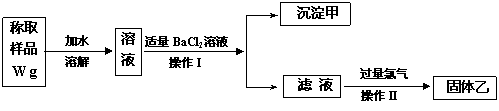
请回答下列问题:
(1)操作I的名称为 ,操作II所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W 1g和W 2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。

参考答案
1~8 ACADCBCC 9~14 AD、BC、B、D、C、C
15.(1)①用蒸馏水湿润(2分) ②检查是否漏水(2分)
(2)BDEH(4分)(错一个倒扣1分,至扣完为止)
16.⑴CaCN2 ⑵ CaCN2 + 3H2O = CaCO3 + 2NH3↑ ⑶ ⑥ ⑦
2NaCl + 2H2O
![]() 2NaOH + Cl2↑+ H2↑
2NaOH + Cl2↑+ H2↑
2Cl2 + 2Ca(OH)2=CaCl2 + Ca(ClO)2 + 2H2O
17.(1)![]()
![]() (2分)
(2分)
(2)PCl5 (3分) (3)P3N3Cl6 (3分)
18.⑴ C5H12O4 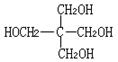
⑵ C(CH2OH)4+4CH3COOH![]() C(CH2OCCH3)4+4H2O
C(CH2OCCH3)4+4H2O
⑶ CH3![]()
![]()
![]() CH2OH HOCH2CH2
CH2OH HOCH2CH2![]()
![]() CH2OH HOCH2
CH2OH HOCH2![]() CH2
CH2![]() CH2OH
CH2OH
19.(1)C8H11NO2 (2)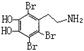
+3Br2→ +3HBr
![]()
![]()
(3)I、加成反应 II、 。 III、 6
20.⑴ Fe2Al ⑶ 2 mol/L 0.1 mol/L
21.I、
⑵Na3NO4+CO2====NaNO3+Na2CO3 Na3NO4+H2O====NaNO3+2NaOH
II、⑴①O=C=C=C=O(1分),非极性(1分)
22、(1) 44(2分)
(2)__N2O______ NO C3H8 C2H6 (2分)
(3)___ C3H8和CH2O _____ C2H4O和C2H6_____(6分)______
23A.(物质结构与性质,12分)
(1)② (2分)
(2)SP3 (1分) 分子晶体 (1分)
(3)1S22S22P63S23P4 (2分) NH3与水分子形成氢键且更易发生化学反应 (2分)
(4)1:1 (2分) 离子键、非极性键 (2分)
23B.(实验化学,12分)
(1)过滤 (1分),玻璃棒、酒精灯 (3分)
(2)否,会引入硝酸钾杂质。 (2分)
(3)![]() (2分)
(2分)
(4)(4分,关键是写出过量K2CO3一步的实验流程,否则不给分)
 |