08届高三化学上册第一次月考试题
化 学 试 题
时间100分钟 总分108分
一、选择题(每小题有1-2个选项符合题意,每小题3分,共66分)
1、下列现象的产生与人为排放大气污染物氮氧化物无关的是:
A、闪电 B、光化学烟雾 C、酸雨 D、臭氧层空洞
2、下列表述正确的是:
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A、①②③ B、②④ C、③④⑤ D、③⑤
3、用NA代表阿伏加德罗常数,下列说法正确的是:
A、0.5 mol Al与足量盐酸反应转移电子数为1 NA
B、标准状况下,11.2 L SO3所含的分子数为0.5 NA
C、0.1 mol CH4所含的电子数为1 NA
D、46 g NO2和N2O4的混合物含有的分子数为1 NA
4、下列实验中,溶液颜色有明显变化的是:
A、少量明矾溶液加入到过量NaOH溶液中
B、往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C、少量Na2O2固体加入到过量NaHSO3溶液中
D、往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
5、对下列事实的解释错误的是:
A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D、反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜不溶于水,也不溶于稀硫酸
6、用向硫酸酸化的碘化钾溶液里加入过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕色,有关叙述有:①向溶液里滴入淀粉溶液显蓝色;②逸出的气泡是HI;③离子方程式为:H2O2+2I-=I2+O2+2H+;④离子方程式为:H2O2+2I-+2H+=I2+2H2O;⑤反应时还有H2O2分解为水和O2,其正确的是
A.、①④⑤ B、 ①②④ C、③④⑤ D、①③⑤
7、石灰在工农业生产和建筑业上有着重要用途。用于生产石灰的主要原料是石灰石(用①表示),在石灰窑中加热焙烧石灰石得到生石灰(用②表示),并放出气体(用③表示)。生石灰在建筑业上主要用作粘合剂,一般先使它“熟化”变成熟石灰(用④表示),熟石灰与砂子混合成灰泥用于砌筑砖墙。经过一段时间后灰泥中的熟石灰变成另一固体物质(用⑤表示)。用下列化学式表示这5种物质都正确的是:
A.①Ca(OH)2,②CaO,③SO3,④CaSO4,⑤CaSO4
B.①CaO,②Ca(OH)2,③CO,④CaCO3,⑤CaSiO3
C.①CaCO3,②CaO,③CO2,④Ca(OH)2,⑤CaCO3
D.①CaCO3,②CaO,③SO2,④CaSiO3,⑤Ca(OH)2
8、物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质: ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而发生不同氧化还原反应的是:
A、①③ B、③④ C、①② D、①③④
9、为确定某溶液的离子组成,进行如下实验: ① 测定溶液的pH,溶液显强碱性。
② 取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③ 在②所得的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④ 取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是:
A、一定有SO32-离子 B、一定有CO32-离子
C、不能确定Cl-离子是否存在 D、不能确定HCO3-离子是否存在
10、混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是:
A、向CuSO4溶液中加入适量铁粉
B、等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C、等物质的量的NaHCO3与Na2O2固体 D、在NaBr溶液中通入过量氯气
11、下列说法正确的是
A、ⅠA族元素的金属性比ⅡA族元素的金属性强
B、ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C、同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D、第三周期元素的离子半径从左到右逐渐减小
12、高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是:
A.臭氧和氧气是氧的同素异形体 B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害 D.臭氧是很好的消毒剂和脱色剂
13、在NH3、HNO3、H2SO4的工业生产中,具有的共同点是:
A.使用吸收塔设备 B.使用尾气吸收装置
C.使用H2作原料 D.使用催化剂
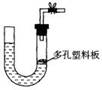 14、下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是:
14、下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是:
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
15、将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的:
A.反应速率:两者相同 B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
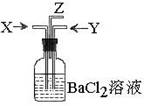 16、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是
16、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是
A、洗气瓶中产生的沉淀是碳酸钡
B、在Z导管出来的气体中有二氧化碳
C、洗气瓶中产生的沉淀是硫酸钡
D、在Z导管口有红棕色气体出现
17、氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是:
![]()
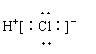 A、一个D2O分子所含的中子数为8 B、NH3的结构式为
A、一个D2O分子所含的中子数为8 B、NH3的结构式为
C、HCl的电子式为 D、热稳定性:H2S>HF
18、某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理不正确的是
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) (标况) | 2.24L | 3.36L | 3.36L |
A、盐酸的物质的量浓度为3.0mol/L B、能计算出混合物中NaHCO3的质量分数
C、加入混合物9.2g时盐酸未反应完 D、15.7g混合物恰好与盐酸完全反应
19、向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中
c(Br-)=3c(Cl-)=0.3mol/L。溶液的体积变化及离子的水解不计,则下列说法中正确的是
A、原溶液的浓度为0.1mol/L B、反应后溶液中c(Fe3+)=0.1mol/L
C、原溶液中c(Br-)=0.4mol/L D、反应后溶液中c(Fe3+)=c(Fe2+)
20、将5.4 g Al投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A、HNO3溶液 B、Ba(OH)2溶液 C、H2SO4溶液 D、HCl溶液
21、Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为:
A、1∶7 B、1∶9 C、1∶5 D、2∶9
22、含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是:
A、Na2S B、NaHS C、Na2S和NaHS D、NaOH和NaHS
二、填空题(包括4小题,每空2分,共42分)
23、(8分)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1∶1和1∶2。高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入NaOH溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是
(2)B煅烧生成C和D的化学方程式是:
甲元素的单质与F溶液反应的离子方程式是:
(3)往G溶液中加入NaOH溶液发生的现象是:
24、(14分)21世纪是全世界大规模开发利用海洋资源、发展海洋经济的新时期。为了人类和平利用海洋资源,今年我国环球科学考察船“大洋一号”首次执行环球大洋科学考察任务。海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。该反应的化学方程式为:
利用电解所得气体制36.5%的浓盐酸1000t,最少需消耗食盐 t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法流程如下:
![]()

请写出②反应的离子方程式: ;
④反应的化学方程式 。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A.皂化反应 B. 与金属钠反应 C. 氧化反应
25、(12分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
![]() ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
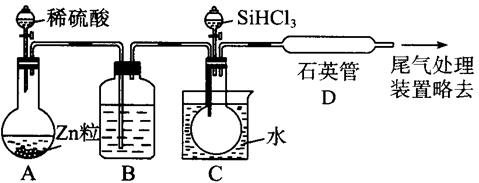
①装置B中的试剂是________________________。(1分)
装置C中的烧瓶需要加热,其目的是____________________________________。(1分)
②反应一段时间后,装置D中观察到有固体生成,装置D不能采用普通玻璃管的原因是:
_______________________________________________________________________(1分);
装置D中发生反应的化学方程式为
___________________________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及______________________________________(1分)
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a. 碘水 b. 氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
26、(8分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
高三第一次月考
化学试题参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | A | D | C | B | C | A | C | A | BC | BD | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | D | B | B | A | B | D | B | D | A | A |
![]() 23、(1)FeS (2) 4FeS2+11O2 2Fe2O3+8SO2 2Fe3++Fe=3Fe2+
23、(1)FeS (2) 4FeS2+11O2 2Fe2O3+8SO2 2Fe3++Fe=3Fe2+
(3)生成白色絮状沉淀,迅速变成灰绿色最后变成红褐色。
24、(1)IA (2)物理变化
![]() (3)2NaCl+2H2O
2NaOH+H2↑+Cl2↑;585
(3)2NaCl+2H2O
2NaOH+H2↑+Cl2↑;585
(4)OH-+SO2=HSO3- NaHSO3+HCl=NaCl+H2O+SO2↑
(5)BC
![]() 25、(1)SiO2+2C
Si+2CO↑
25、(1)SiO2+2C
Si+2CO↑
(2)蒸馏(或分馏)
(3)①浓硫酸; 使滴入烧瓶中的SiHCl3气化
② 在反应温度下,普通玻璃会软化 ; SiHCl3+H2![]() Si+3HCl
Si+3HCl
③排尽装置中的空气 ④b d
26、(1)5.8 ;5.4 (2)(aV·10-3+0.5/0.14 (3)57.8