08届高三化学上册第一次段考试题
化 学
(满分为120分 考试时间100分钟)
命题:于新国 审校:朱加钢
相对原子质量:H-1;C-12;N-14;O-16;Na-23;P-31;S-32; Cu-64;
第Ⅰ卷(选择题 共56 分)
一、选择题(本题共8小题,每小题3分,共24分。每小题只有1 个选项符合题意)
1.“显微学的新前沿”被列为美国科学杂志2006年度十大科技进展之一。生物学家借助新的显微技术,成功观察到小于200纳米的细节。下列分散系中,分散质微粒半径最小的是
A.雾 B.蛋白质溶液
C.NaCl溶液 D.新制氢氧化铜悬浊液
2.氧可与许多元素形成化合物,下列有关叙述错误的是
A.水分子的结构式为 ![]()
B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价
C.Na2O2的电子式为Na+![]() Na+
Na+
D.在MgO晶体中,O2-的电子排布式可表示为 1s22s22p6
3.用右图表示的一些物质或概念间的从属关系中不正确的是
| X | Y |
| |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 碱性氧化物 | 金属氧化物 | 氧化物 |
| D | 电解质 | 离子化合物 | 化合物 |
4.下列对有关化学反应过程或实验现象的解释中,正确的是
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
5.下列氧化还原反应中,水作为氧化剂的是
A.CO+H2O![]() CO2+H2
CO2+H2
B.3NO2+H2O = 2HNO3+NO
C.2Na2O2+2H2O = 4NaOH+O2↑
D.2F2+2H2O = 4HF+O2
6.实验室用质量分数为98%、密度为1.84g·cm—3的浓硫酸配制100g 10%H2SO4溶液。配制过程中需要用到的仪器有:
①托盘天平 ②10mL量筒 ③100mL量筒 ④烧杯
⑤玻璃棒 ⑥100mL容量瓶 ⑦胶头滴管
A.①④⑤⑥⑦ B.②③④⑤⑦ C.②④⑤⑥⑦ D.②③④⑤⑥⑦
7.为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入
A.水;碱石灰 B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液 D.饱和Na2CO3溶液;稀H2SO4
8.下列说法不正确的是
A.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
B.常温常压下,金属和酸反应,若生成2g 氢气,则有2mol电子发生转移
C.常温常压下,1mol氮气含有阿伏加德罗常数个氮分子
D.标准状况下,1L H2O约含有1/22.4 mol的H2O分子
二、选择题(本题共8小题,每小题4分,共32分。每小题有1个或2个选项符合题意)
9.下列说法错误的是
A.分子晶体的状态变化,只需克服分子间作用力
B.原子晶体中只存在非极性共价键
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔融状态下能导电
10.下列有关说法正确的是
A.检验溶液中是否含SO42-时,在无其它阳离子干扰时,所加的BaCl2溶液用盐酸酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色
D.溴乙烷水解后的碱性溶液不能用硝酸酸化,因为硝酸会把Br- 氧化,再加入AgNO3溶液则不会产生浅黄色沉淀
11.下列叙述中,正确的是
A、含金属元素的离子不一定都是阳离子
B、在氧化还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
12.下列反应的离子方程式正确的是
A.Cu和稀硝酸反应:3Cu + 8H+ + 2NO3- △ 3Cu2+ + 2NO↑+ 4H2O
B.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
C.Ca(HCO3)2溶液与过量的NaOH溶液反应:
Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O
D.等物质的量浓度、等体积的NH4HCO3溶液与NaOH溶液相混合:
NH4+ + HCO3- + 2OH- = NH3·H2O + CO32- + H2O
13.在解释物质性质变化规律与物质结构间的因果关系时,与键能无关的变化规律是
A.F2、Cl2、Br2、I2的沸点逐渐升高
B.与硅相比,金刚石的硬度大,熔点高
C.HF、HCl、HBr、HI热稳定性依次减弱
D.H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶
14.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
C.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS-
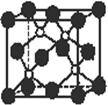 15.磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复 结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
15.磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复 结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点低,且熔融状态下能导电
C.磷化硼晶体中原子间以共价键连接,属于原子晶体
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
16.下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
洪泽中学2008届高三第一次段考
化 学
◆请将选择题答案填入下表中
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题,共64分)
三、(本题包括2小题,共18分)
17.(10分)现有下列仪器或用品:a.铁架台(含铁圈、铁夹)b. 锥形瓶 c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计
现有下列试剂:A、NaOH固体 B、碳酸钠溶液 C、氯化镁溶液 D、蒸馏水
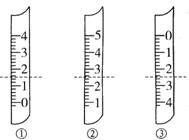 试填空:
试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是____________
A.①是量筒,读数为1.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
(2)配制一定物质的量浓度的氢氧化钠溶液时,还缺少的一种仪器是__________。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用的试剂是:________(选填序号),操作方法是__________、加入试剂、_________、洗涤。完成上述操作,上述仪器或用品用到的有____________________(从上述仪器或用品中选择,并填上相应序号)。
18.(8分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:


(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是_____________________(填操作名称)
四、(本大题共2小题,共21分)
19.(13分)下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
| A | B | ||||||||||||||||
| C | M | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| N | J | ||||||||||||||||
| K | L |
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是________________(填“元素符号”);
(2)下列叙述正确的是_____________(填字母序号)
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.MA2E分子中M原子采取sp2杂化方式
d.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA4+离子的空间构型 ,ME2的空间构型 ;
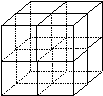 (4)元素F和元素I形成的化合物是
晶体(填晶体类型), 右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素F和元素I所在位置。
(4)元素F和元素I形成的化合物是
晶体(填晶体类型), 右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素F和元素I所在位置。
(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,该配合物中的配位体为 。
20.(8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。
现有一氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是____________,化合价没有发生变化的反应物是______________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)。
________________________________________________________。
(3)上述反应中,氧化剂是______________,1 mol氧化剂在反应中_________(填“得到”或“失去”)___________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_________________________________________。
五、(本题包括2小题,共18分)
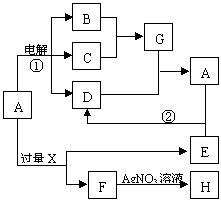 21.(8分)已知A是由两种中学常见元素组成的盐,A溶于水显酸性;B、C常温下为气体,B为无色,C为黄绿色;H、D为白色沉淀,D是一种两性氢氧化物;X和E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
21.(8分)已知A是由两种中学常见元素组成的盐,A溶于水显酸性;B、C常温下为气体,B为无色,C为黄绿色;H、D为白色沉淀,D是一种两性氢氧化物;X和E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
(1)X的化学式为________________;
(2)G是由______性共价键构成的_______性分子;
(3)C的电子式为________________。
(4)写出反应①、②的离子方程式:
①_________________________________________。
②_________________________________________。
22.(10分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:
______________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_________________________________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________(填化学式)。
六、(本题包括1小题,共7分)
23.(7分)将10 g复盐CuSO4·x(NH4)2SO4·yH2O加到过量的NaOH溶液中,加热;生成的氨用100 mL 0.5 mol/L硫酸全部吸收,多余的硫酸用2mol/L NaOH溶液中和,用去NaOH溶液25 mL。已知复盐中SO42-的质量分数为48%,
(1)求生成氨的物质的量
(2)计算x和y的值。
08届高三第一次段考化学参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |||||||
| C | B | D | C | A | B | B | D |
| |||||||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | ||||||||
| B | A | AD | AC | AD | C | C | B | ||||||||
三、(10+8=18)
17、(10分)(1)A、D(2分) (2)容量瓶(1分)
(3)C、D(2分) 溶解、过滤(2分) a、d、e、f、h、j (3分)
18、(1)氯化钡溶液或硝酸钡溶液 硝酸银溶液 硝酸溶液(各1分)
(2) 测定溶液的pH(1分) (3) 除去溶液中过量的Ba2+、Ag+(2分)
(4) 蒸发、冷却结晶、过滤(2分)
 四、(13+8=21)
四、(13+8=21)
19.(13分) (1)He、Be、Fe (2分) (2)a、c (2分)
(3)正四面体型、直线型(2分) (4)离子晶体 (1分)结构图(2分)
(5)绿色晶体的化学式是[TiCl(H2O)5]Cl2·H2O(2分); H2O、Cl-(2分)
20.(1)KCl;H2SO4 (2)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O (3)KMnO4;得到;5 (4)NaBiO3具有强氧化性(比KMnO4氧化性强)
(化学方程式2分,其余每格1分,共8分)
![]()
![]()
![]()
![]()
![]() 五、(18分)
五、(18分)
|
(4)①2Al3++6Cl-+6H2O![]() 3H2↑+3Cl2↑+2Al(OH)3↓
3H2↑+3Cl2↑+2Al(OH)3↓
![]() ②Al3++3AlO2-+6H2O=4Al(OH)3↓(每空2分,不配平扣1分,条件不写扣1分)
②Al3++3AlO2-+6H2O=4Al(OH)3↓(每空2分,不配平扣1分,条件不写扣1分)
22.(10分)(1)1:2 (2分)(2)3NF3+5H2O = 2NO+HNO3+9HF(3分),0.4NA或2.408×1023 (2分)(3)产生红棕色气体、产生刺激性气味气体、产生白雾(写出1个即得分,2分)(4)NaNO3 (1分)
六、(7分)
23、(1) n(H2SO4)= 0.5mol/L×0.1L=0.05mol……1分
n(NaOH)= 2mol/L×0.025L=0.05mol……1分
n(NH3)=2×(0.05mol/L-0.05mol×1/2)=0.05mol……1分
(2)10g复盐中:n(SO42-)=10g×48%÷98g/mol=0.05mol ……………1分
n(Cu2+)=0.05mol-0.05mol×1/2=0.025mol……………………1分
n(H2O)=(10g-0.025mol×160g/mol-0.025mol×132g/mol)÷18g/mol =0.15mol……1分
n(CuSO4)∶n[(NH4)SO4]∶n(H2O)= 0.025mol∶0.025mol∶0.15mol=1∶1∶6
∴ x=1,y=6…………………………1分
答:生成氨的物质的量为0.05mol,复盐中x和y的值分别为1和6。
洪泽中学2008届高三第一次段考化学试题双向细目表
| 试题内容 | 题号 | 分值 | 试题难易预测 | |||||
| 容易 | 中等 | 较难 | ||||||
| 选3第1、2章 | 原子分子结构 | 2 | 3 | 17 | 选3 28分 23% | 3 | ||
| 键能 | 13 | 4 | 4 | |||||
| 原子结构与周期律 | 19(1)(2) | 4 | 4 | |||||
| 分子构型 | 19(3) | 2 | 2 | |||||
| 配合物化学式与配位体 | 19(5) | 4 | 4 | |||||
| 选3第3章 晶体 | 晶体结构性质 | 9 | 4 | 11 | 4 | |||
| 晶体结构 | 15 | 4 | 4 | |||||
| 晶体结构 | 19(4) | 3 | 3 | |||||
| 实验 | 溶液配制 | 6 | 3 | 28 | 化1 1章 42分 35% | 3 | ||
| 气体除杂干燥 | 7 | 3 | 3 | |||||
| 离子检验 | 10 | 4 | 4 | |||||
| 仪器和除杂 | 17 | 10 | 10 | |||||
| 混合物分离 | 18 | 8 | 4 | 4 | ||||
| 物质 的量 | NA | 8 | 3 | 14 | 3 | |||
| 气体摩尔体积 | 16 | 4 | 4 | |||||
| 物质的量应用 | 23 | 7 | 3 | 4 | ||||
| 分类与 分散系 | 物质分类 | 3 | 3 | 6 | 化1 2章 39 33% | 3 | ||
| 分散质粒子直径 | 1 | 3 | 3 | |||||
| 离子反应 | 离子方程式 | 12 | 4 | 8 | 4 | |||
| 离子共存 | 14 | 4 | 4 | |||||
| 氧化 还原 | 氧化还原概念 | 11 | 4 | 25 | 4 | |||
| 氧化性还原性 | 4 | 3 | 3 | |||||
| 氧化剂 | 5 | 3 | 3 | |||||
| 氧化还原应用 | 20 | 8 | 8 | |||||
| 氧化还原应用 | 22(1)(2) | 7 | 7 | |||||
| 无机 综合 | 无机框图 | 21 | 8 | 11 | 9% | 4 | 4 | |
| 无机反应 | 22(3)(4) | 3 | 3 | |||||
| 分值 | 120 | 35 | 62 | 19 | ||||
 Z
Z