08届高三化学上学期期末调研试题
(新高考模式)
化学试题
本试卷分选择题(第1题~第14题,共48分)和非选择题[第15题~第21题(其中第21题为选做题,考生只要在A、B两题中任选一题作答,如果两题均作答,则以A题得分计入总分),共72分]两部分,满分120分,考试用时100分钟。
可能用到的相对原子质量:
H:1 N:14 C:12 O:16 Ag:108
一、单项选择题:本题有8小题,每小题3分,共24分。每小题只有一个选项符合题意。
1.“假说”在化学科学的研究和发展中起到不可替代的作用。下列“假说”在化学科学发展过程中曾经起到一定的作用,从目前的化学理论看,仍然科学的是
A.道尔顿提出的“每一元素的原子以其原子质量为其特征”
B.阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”
C.贝采里乌斯提出的“不同原子带不同的电性,因而产生吸引力,由此形成化合物”
D.盖·吕萨克提出的“在同温同压下,相同体积的不同气体含有相同数目的原子”
2.下列对一些实验事实的理论解释正确的是
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A. | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B. | CO2为直线性分子 | CO2分子中C=O之间的夹角为180° |
| C. | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D. | HF的沸点高于HCl | HF的相对分子质量小于HCl |
3.NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
B.标准状况下,11.2 L NO2和11.2 LN2O4的混合物所含的分子数为1.5 NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子总数为3 NA
4.下列图式正确的是
![]()
A.氟化氢的电子式: B.次氯酸的结构式: H-Cl-O
![]()
![]()
C.铝离子的结构示意图 D.氯化铯的晶体结构(晶胞)模型:
5.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是 A.60mL B.45mL C.30mL D.15mL.
6.在298K、1.01×105 Pa下,12 g石墨在24 g氧气中燃烧至反应物完全消耗,测得放出x kJ(x>0)的热量。已知在该条件下,1 mol石墨完全燃烧放出y kJ(y>0)的热量。则石墨与氧气反应生成CO的热化学方程式表达正确的是
A、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)= -y kJ·mol—1
O2(g)=CO(g) △H(298K)= -y kJ·mol—1
B、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)= -x kJ·mol—1
O2(g)=CO(g) △H(298K)= -x kJ·mol—1
C、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)= -(2x-y)kJ·mol—1
O2(g)=CO(g) △H(298K)= -(2x-y)kJ·mol—1
D、2C(石墨,s)+O2(g)=2CO(g) △H(298K)= -(2x-y)kJ·mol—1
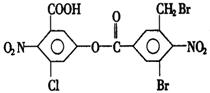 7.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如右图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑硝基与氢氧化钠的反应),则a是
7.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如右图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑硝基与氢氧化钠的反应),则a是
A.5mol B.6mol
C.7mol D.8mol
8.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐。
A![]()
下列说法不正确的是
A. 当X是强酸时,ABCDEF均含有同一种元素,F是硫酸
B. 当X是强碱时,ABCDEF均含有同一种元素,F是硝酸
C. B和Cl2的反应一定是氧化还原反应
D. 当X是强酸时,C常温下是气态单质
二、不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分
9.两种短周期元素组成的化合物中原子数比为1:3,若两种元素的原子序数分别是a和b,则a和b的关系可能是① a=b+5 ② a+b=8 ③ a+b=30 ④ a=b+8
A、①②③④ B、②③④ C、②③ D、③④
10.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
11.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
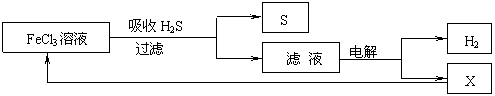 |
A.吸收H2S的离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl——2e-═Cl2↑
C.该工艺流程体现绿色化学思想
D.实验室可用点燃充分燃烧的方法消除H2S污染
12.下列实验操作完全正确的是
| 编号 | 实 验 | 操 作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000 mL | 准确称取氯化钾固体,放入到1000 mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
13.一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是负极,电极反应为:O2 + 4e- = 2 O2-
D、通入丁烷的一极是负极,电极反应为:C4H10 - 26e- + 13 O2-= 4CO2 + 5H2O
14.将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀盐酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于
A.11.2bc×10-3 B.22.4bc×10-3
C.22.4(3a-4bc×10-3) D.22.4(3a-4bc)×10-3
三、本题包括2小题,共18分。
15.(4分)下列实验能达到预期目的的是__________
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②用氢氧化钠溶液除去苯中的少量苯酚
③用饱和碳酸氢钠溶液除去二氧化碳中的少量二氧化硫
④用加热的方法提取NH4Cl固体中混有的少量碘
⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐
⑥用米汤检验碘盐中含碘
⑦用碘酒验证汽油中含有不饱和烃
16.(14分)下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
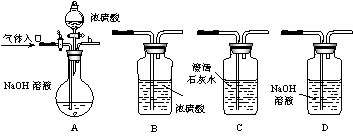

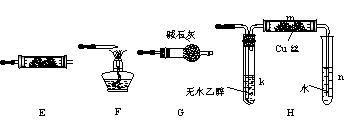

(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为___________ (填装置代号)。能验证CO氧化产物的现象是___________________________________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应_________,需要加热的仪器装置有___________(填仪器代号),m中反应的化学方程式为____________________________________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:_______________________________________________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有___________性。
四、本题包括1小题,共16分。
17.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
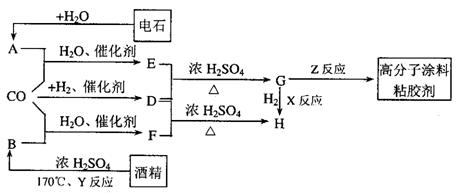
图中G(RCOOR*)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H![]() 按物质的理之比为1∶2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物。试写出:
按物质的理之比为1∶2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物。试写出:
(1)结构简式: E_____________、G_________________。
(2)G的两个同类别同分异构体的结构简式 _____________________、_____________________。
(3)G的同分异构体中核磁共振氢谱只有一种的结构简式___________。
(4)反应类型: X______________Y______________。
(5)写出下列转化的化学方程式:
![]() ①A+CO+H
①A+CO+H![]() O
O ![]() E; ②F+D
H。
E; ②F+D
H。
①______________________________________________________________。
②______________________________________________________________。
五、本题包括1小题,共12分。
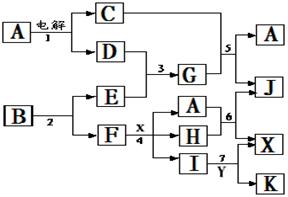
18.下图中A是一种无色液体,G是一种极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应5是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式
A 、E 、F 、K ;
(2)写出反应5的化学方程式
(3)1molB通过反应2得到1molF,B中F的
质量分数为72%, 则B的化学式为
(4)写出反应4的离子方程式
六、本题包括1小题,共8分。
19.工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),△H
= -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H
= -92.44kJ/mol;其部分工艺流程如下:
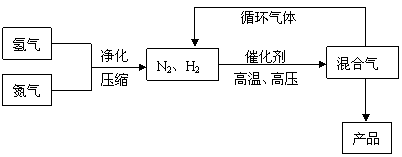 |
反应体系中各组分的部分性质见下表:
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填增大、减小、不变)。
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
七、本题包括1小题,共6分。
20.在进行胃部透视时,为取得良好的检查效果,需要在检查之前服用“钡餐”,“钡餐”的主要成分是硫酸钡。在25℃时,1L水中约能溶解2.4×10-3g 硫酸钡,它的溶度积常数Ksp=1.1×10-10。
(1)钡离子是一种有毒的重金属离子,当人体中钡离子浓度达到2×10-3mol·L-1时,就会对健康产生危害。请通过计算说明为什么可以用硫酸钡作为“钡餐”。
(2)在25℃时,1L水中约能溶解0.018g 碳酸钡,且胃液是酸性的,能否用碳酸钡代替硫酸钡作为“钡餐”的主要成分?
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
21A.(物质结构)下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
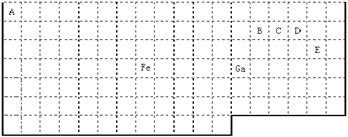
根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和 _____(填化学式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4— 离子的空间构型为______________型。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写3种)
21B.(实验化学)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
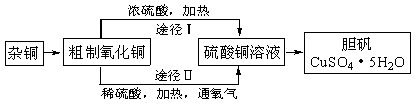
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、_____、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是: 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
 08年高考化学模拟试卷答案卷
08年高考化学模拟试卷答案卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |

一.
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
二.
 |
三、(本题包括2小题,共18分)
15.(4分) 。
16.(1) 、
(2) ; 。 ; 。(3)①
。
② 。
 |
四、本题包括1小题,共16分。
17.(1) E_____________、G_________________。
(2)________________________、________________________。
(3)___________ 。
(4) X______________Y______________。
(5)
①______________________________________________________________。
②______________________________________________________________。
 |
五、本题包括1小题,共12分。
18.(1)写出下列物质的化学式[(1)每空各1分,共4分, (2)、(3)各3分]
A 、E 、F 、K ;
(2)写出反应5的化学方程式
(3)则B的化学式为
(4)写出反应4的离子方程式

 六、本题包括1小题,共8分。
六、本题包括1小题,共8分。
19.(1) 。 (填增大、减小、不变)
(2) (填序号)。
(3) 使 分离出来;循环的气体是 。

七、本题包括1小题,共6分。
20. (1) ______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
(2)
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
 |
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
21A. (1) 。
(2) ; __________; ____和 _____(填化学式)。
(3) 。
(4)______________ 。______________________________ (3种)
21B. (1) , , 。
(2)
(3) _____ 、 。
(4) 、 。
(5) 。
(6)
参考答案
一.1. B 2. A 3. D 4. D 5. A 6 .C 7.D 8. D
二.9. A 10.BC 11. AC 12. C 13. BD 14.A
三.(本题包括2小题,共18分)
15.(4分)2 3 5 7 (每个一分)
16.(1)ACBECF; AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊。 (4分)
(2)关闭、打开; k 、m; 2CH3CH2OH+O2![]() 2CH3CHO+2H2O。 (6分)
2CH3CHO+2H2O。 (6分)
(3)①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出; 氢氧化钠吸水,促使氨放出; 氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出。(3分)②还原。(1分) (共4分)
四、本题包括1小题,共16分。
17.(1)E: CH![]() =CHCOOH: G:CH
=CHCOOH: G:CH![]() =CHCOOCH
=CHCOOCH![]() ;
;
(2)HCOOCH![]() CH=CH
CH=CH![]() ;
CH
;
CH![]() COOCH=CH
COOCH=CH![]() 。
。
(3)CH![]() COCO CH
COCO CH![]()
(4)X:加成反应;Y:消去反应;(每空各1分,其它每空各2分)
(5)①HC≡CH+CO+H![]() O
O![]() H
H![]() C=CHCOOH
C=CHCOOH
②CH![]() CH
CH![]() COOH+CH
COOH+CH![]() OH
OH![]()
![]() CH
CH![]() CH
CH![]() COOCH
COOCH![]() +H
+H![]() O
O
五、本题包括1小题,共12分。
18.(1)A . H![]() O E . N2 F
. Ag K. AgCl ;(各1分,共4分)
O E . N2 F
. Ag K. AgCl ;(各1分,共4分)
(2)4NH3+5O2![]() 4NO+6H2O
(2分)
4NO+6H2O
(2分)
(3) ![]() (3分)
(3分)
(4) ![]() + 2
+ 2 ![]() + NO3- ==
+ NO3- == ![]() + NO2↑ + H2O (3分)
+ NO2↑ + H2O (3分)
六、本题包括1小题,共8分。
19.(1) (略) 、 减小。 (2) A B
(3) -33.42 NH3 (4) N2 H2
七、本题包括1小题,共6分。
20. (1) BaSO4(s)![]() Ba2+(aq)+
SO42-(aq) 1分
Ba2+(aq)+
SO42-(aq) 1分
[Ba2+] = 1.05 × 10-5mol·L-1 < 2×10-3 mol·L-1 1分
胃液中H+ 对BaSO4的沉淀溶解平衡没有影响,因此BaSO4可用做“钡餐”。1分
(2)BaCO3(s)![]() Ba2+(aq)+ CO32-(aq)(1分),由于胃液是酸性的,如果服下BaCO3,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,从而使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒(2分)。
Ba2+(aq)+ CO32-(aq)(1分),由于胃液是酸性的,如果服下BaCO3,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,从而使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒(2分)。
八、本题分A、B两题,本题共12分。
21A.(1)4s24p1
(2)d 0 N2 CN- C≡O (每个1分,共5分)
(3)CH4 CH3OH (每个1分,共2分)
(4)正四面体;可以为CO2、NCl3、CCl4、CO等电子式中的2个 (每个1分,共3分)
21B. (1)c; e; b。 (2)a; b。 (3)蒸发; 过滤。
(4)产生等量胆矾途径II消耗硫酸少; 途径II不会产生污染大气的气体。
(5)4。 (6)a。 [只有(6)2分,其它各1分]