08届高三化学上学期测试试题
命题人:韩厚兵
第Ⅰ卷(选择题 共48分)
(考试时间:100 分钟 全卷总分:100 分)
可能用到的相对原子质量:
H : 1 C : 12 Br : 80 I : 127 N : 14 O : 16 P : 31
Si : 28 S : 32 Na : 23 Mg : 24 Al : 27 Cu : 64 Ag: 108
一、选择题(本题包括16小题。每小题只有一个正确选项。每小题3分)
 1.2007 年诺贝尔化学奖德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
1.2007 年诺贝尔化学奖德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快 CO 氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2 可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
2.对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,一定有CO32-或SO32-
B.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.某气体能使湿润红色石蕊试纸变蓝,该气体一定显碱性
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
3.英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷 ( As )的有关判断正确的是
A.砷原子序数为 33 ,它与铝为同主族 B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强 D.砷酸的酸性比硫酸的弱
 4.某学生积极思考产生喷泉的其他办法,并设计了如图所示装置,在锥形瓶中分别
加入足量的下列物质,反应后可产生喷泉的是
4.某学生积极思考产生喷泉的其他办法,并设计了如图所示装置,在锥形瓶中分别
加入足量的下列物质,反应后可产生喷泉的是
A.锌片与稀硫酸 B.NH4Cl溶液与Ba(OH)2溶液
C.CaCO3与稀硫酸 D.铁片与浓硝酸
5.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了 8 个电子的结构。则一个三硫化四磷分子中含有的共价键个数是
A.7 个 B.9 个 C.19 个 D.不能确定
6.2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
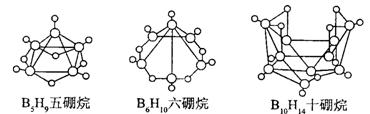
A.这类巢式硼烷的通式是 C nH n + 4
B.2B5H9
+ 12O2![]() 5B2O3 十9H2O
,l molB5H9完全燃烧转移25mol电子
5B2O3 十9H2O
,l molB5H9完全燃烧转移25mol电子
C.8 个硼原子的巢式棚烷化学式应为 B8H10
D.硼烷与水反应是非氧化还原反应
 7.下列实验装置图完全正确的是
7.下列实验装置图完全正确的是

A.称量氢氧化 B.配制150 mL C.分离苯和甲苯 D.简易测定
钠固体 0.10 mol·L-1盐酸 中和热
8.下列离子方程式书写正确的是
A.向饱和NaHCO3溶液中通入过量SO2:SO2+HCO![]() =CO2↑+HSO
=CO2↑+HSO![]()
B.亚硫酸氢铵溶液和足量氢氧化钠溶液的反应:NH4++OH-=NH3·H2O
C.澄清石灰水与少量Ca(HCO3)2溶液混合:
Ca2++2OH-+2 HCO3- CaCO3↓+CO32-+2H2O
D. NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液:
Al3++2SO42—+2Ba2++4OH—=AlO2—+2BaSO4↓+2H2O
9.元素 X 的离子和其含氧酸根离子,在 pH=0的溶液中产生X 的单质沉淀,且氧化产物与还原产物质量之比为 2 : 1 . X 可能是
A.氯 B.硫 C.硅 D.铝
10.充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学基本要求。 ① 在有机实验中,用溴的四氯化碳溶液代替溴的水溶液; ② 用稀硝酸代替浓硝酸溶解、回收含银镜试管里的银; ③ 用水浴加热代替直接用洒精灯加热; ④ 接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水; ⑤ 工业合成氨中分离产物得到氢气和氮气再循环使用; ⑥ 电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物。上述主要不是从绿色化学角度考虑的是
A.①③ B.②④ C.⑤⑥ D.③④
11.同温同压下,将NO2、NO、O2按一定的体积比充满一容器,再倒置于盛有水的水槽中,片刻液体充满了容器。则反应前NO2、NO、O2的体积比是
A.1︰1︰1 B.4︰3︰1
C.4︰24︰17 D.4︰16︰7
12.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与0.84 L O2(标准状况)混合后通入水中,气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3 mol·L-1 NaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液体积是
A.45 mL B.50 mL C.30 mL D.60 mL
13.在298K、1.01×105 Pa下,12 g石墨在24 g氧气中燃烧至反应物完全消耗,测得放出x kJ(x>0)的热量。已知在该条件下,1 mol石墨完全燃烧放出y kJ(y>0)的热量。则石墨与氧气反应生成CO的热化学方程式表达正确的是
A、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)=-y kJ·mol—1
O2(g)=CO(g) △H(298K)=-y kJ·mol—1
B、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)=-x kJ·mol—1
O2(g)=CO(g) △H(298K)=-x kJ·mol—1
C、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)=-(2x-y)kJ·mol—1
O2(g)=CO(g) △H(298K)=-(2x-y)kJ·mol—1
D、2C(石墨,s)+O2(g)=2CO(g) △H(298K)=-(2x-y)kJ·mol—1
14.物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节。下列有关叙述中,不正确的是
A.乙酸乙酯中混有乙酸,可选用饱和 Na2CO3溶液洗涤,然后将两层液体分开
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4+)2SO4溶液,然后将所得沉淀滤出,即得较纯的蛋白质
C.油脂的提纯中,可将油脂加入浓 NaOH 浓液中加热,然后过滤,滤出的溶液即为较纯的油脂
D.甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖
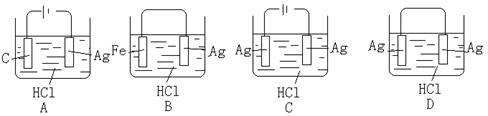
15、某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是:
16.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是
![]() A.若X为Fe,Y可为Cl、Br、I
A.若X为Fe,Y可为Cl、Br、I
B.若X为Fe,Y只能为Cl
C.X一定为金属元素
D.X、Y可能均为非金属元素
第二卷(非选择题 共52分)
17.某学生在实验室做了5个实验( 3分)
(1)在铝盐溶液中逐滴加入稀氨水直至过量,(2)在明矾溶液中加入NaOH溶液直至过量,(3)在强碱性溶液中逐滴加入铝盐溶液直至过量,(4)在偏铝酸钠溶液中通入CO2直至过量,(5)在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。
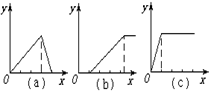 | 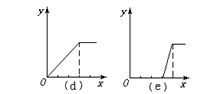 | ||
并根据以上实验画出下列5种图象(纵坐标为沉淀物质的量,横坐标为溶液中加入物质的量)实验与图象对立关系正确的是:___________。
A.(1)和(a) B.(2)和(b) C.(3)和(e) D.(4)和(c)
18.(10 分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为棕色;
③ 取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失;
④ 取溶液少许,滴人氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
请回答下列问题:
( l )在实验 ① 中,下图所示的操作中正确的是___________(填代号)
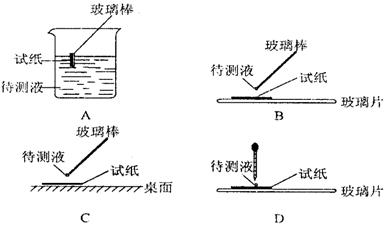
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子__ ___。
(3)写出与 ② ③ 两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
19.( 8 分)A、B、C、D 四种短周期元素,原子序数依次增大, A 原子的最外层上有 5 个电子; B 的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体 E , D 的 L 层电子数等于 K、M 两个电子层上的电子数之和。
( 1 ) A 的最高价氧化物的水化物是___________(填化学式);
( 2 )物质 E 中所包含的化学键有______________,写出 C、D 两元素形成的化合物 C2D 的电子式______________________;
( 3 )把盛有 48mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为 24 mL,则原混合气体中 AB 的体积分数为__________。
20.(10分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
| a | |||||||
| b |
|
| c | d | e | f | |
| g | h |
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
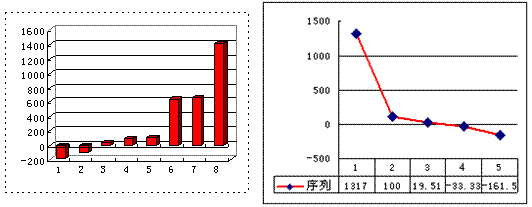
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
(5)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的___极发生电极反应,电极反应式为 。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
姓名 学号 成绩
17.(3分)
18.(10分)( l)正确的是___________(填代号)
(2)肯定存在的离子是_____________________,肯定不存在的离子___________。
(3)写出与 ② ③ 两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
19.( 8 分) ( 1 ) ____ __; ( 2)______________, _________________; ( 3 )__________。
20.(10分)(1) 、 。(2) 。
(3) 。(填化学式)(4)名称是 ,结构式为 。
(5)电极反应式为 。
21.(14分)当前,一次性筷子、一次性饭盒的安全已受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为使筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
⑴铅的元素符号是 ,它在周期表中的位置是 。
⑵防止或减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。
①为研究SO2的溶解性质,某学生做如下实验:如下图,锥形瓶中收集的是SO2,瓶塞系着瘪气球,气球与大气相通。向瓶中滴加紫色石蕊试液,实验现象: 。
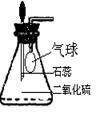 ②为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,
②为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,
能说明SO2在水中的溶解度大于CO2在水中溶解度的实验现象是:
。
③某学生用试管取出上述①实验后的瓶中溶液适量,滴入少量品红溶液,充分振荡,实验现象为: ,接着向溶液加入足量氯水,实验现象为: ,再滴加BaCl2溶液,实验现象为: 。
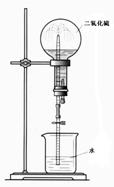 ④有人利用SO2易溶于水的性质设计成如图所示的装置进行喷泉实验,但实验
④有人利用SO2易溶于水的性质设计成如图所示的装置进行喷泉实验,但实验
效果并不理想,请对该设计进行适当改进,以利于完成效果明显的喷泉实验。
A、可将水改为 溶液;
B、也可对装置进行改进(请提出两种改进方案)
方案一:
方案二:
⑶制一次性筷子有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥打磨,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为: 。
 22.( 7 分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 45.3g
的该结晶水合物,分别制成溶液。向其中一份逐滴加人 NaOH 溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到 2.24L 该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加人 Ba (OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体 46.6g 。
22.( 7 分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 45.3g
的该结晶水合物,分别制成溶液。向其中一份逐滴加人 NaOH 溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到 2.24L 该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加人 Ba (OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体 46.6g 。
请回答以下问题:
( l )该结晶水合物中含有的两种阳离子是______和_________,阴离子是___________。
( 2 )试通过计算确定该结晶水合物的化学式。
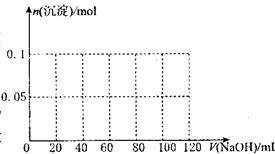
( 3 )假设过程中向该溶液中加人的 NaOH 溶液的物质的量浓度为5mol·L一1,请在右图中画出生成沉淀的物质的量与加入 NaOH 溶液体积的关系示意图。
高三化学试题
化学答案、评分标准
1.D 2.C 3.D 4.A 5.B 6.A 7.C 8.A
9.B 10.A 11.A 12.B 13.C 14.C 15.C 16.D
17.CD ( 3分) 18.( 1 ) B D ( 2 分)
(2)一定有 NO3-、Al3+、SO42-(2分);一定无 Fe3+、Ba2+、HCO3-(2分)
(3)②3Cu + 8H+ + 2NO3-= 3Cu2+ + 2NO↑+ 4H2O 2 分)
③Al3+ + 3 NH3·H2O = Al(OH)3↓+3NH4+ (2分)
19. ( l ) HNO3 , (2分) ( 2 )离子键、(非极性)共价键,(2分)
![]() ,(2分) (
3 ) 25 %(2分)
,(2分) (
3 ) 25 %(2分)
20.(10分)(1)O2- O22-(或O2-、O3-)(2分)
(2)2OH—+2Al+2H2O=2AlO2—+3H2↑(2分)
(3)Si(1分)( 4)甲烷(1分) H—O—H (1分)
(5)负(1分)H2+2OH—-2e—==2H2O(2分)
21.(1)Pb(1分) 第六周期第ⅣA族(1分)
(2)①紫色石蕊试液变红(1分)、气球鼓胀起来(1分)。
② SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度(1分)。
③品红溶液的红色褪去(1分),溶液显浅紫色(1分)。先变红后褪色(1分)。
生成白色沉淀(1分)。④A、NaOH等强碱 (1分)
B、 方案一:增大胶头滴管的容量(2分)
方案二:适当缩短烧杯与烧瓶间距离(即缩短导管的长度)
方案三:减小导管的直径等
(3)Mg3(Si4O10)(OH)2或3Mg O·4SiO2·H2O(2分)
21.【答案】(l ) NH4+ Al3+ SO42- (2分)
(2)NH4 Al(SO4)2·12H2O [或(NH4)2SO4·A12 (SO4)3·24H2O](2分)
( 3 )如图:(3分)
【解析】(1)根据题意可以判断原物质中含有的离子是NH4+ Al3+ SO42-
(2)n (SO42-)==0.1mol
n (NH4+)== ==0.1mol
根据离子化合物中阴、阳离子电荷守恒的原理:
n (NH4+)+3n (Al3+)=2n (SO42-)可得:
n (Al3+)==(2×0.2mol-0.1mol)==0.1mol
n(H2O)=1.2mol
n (NH4+) : n (Al3+) : n (SO42-) : n(H2O )==0.1 : 0.1 : 0.2 : 1.2==1 : 1 : 2 : 12
该结晶水化物的化学式为:NH4 Al(SO4)2·12H2O [或(NH4)2SO4·A12 (SO4)3·24H2O]
(3)先分成三段进行计算,分别求出临界值,然后再作图像。
根据Al3+ + 3OH-=Al(OH)3↓
1 3
0.1 5V1 求出V1=0.06L=60mL(沉淀达到最大值)
根据NH4+ + OH-=NH3·H2O
1 1
0.1 5V2 求出V2=0.02L=20mL
对应临界点的横坐标值为 60mL + 20mL = 80mL
根据Al(OH)3+ NaOH = NaAlO2 + 2H2O
1 l
0.1 5V3 求出 V3==0.02L==20mL (沉淀完全溶解)
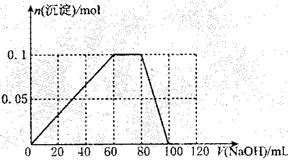 对应临界点的横坐标值为 60mL + 20mL + 20mL == l00mL
对应临界点的横坐标值为 60mL + 20mL + 20mL == l00mL
作出图象如下: