08届高三化学上学期第一次月考试题
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Ca-40 Cu-64 Zn-65 S-32 Mg 24 He 4 Cl 35.5 Fe 56 Al 27
第I卷(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.下列关于社会热点或者实验室守则的描述不正确的是
禁止无铅汽油的使用是为了提高汽油的燃烧效率
‚海洋中赤潮的产生主要由于向海洋中排放过多富含磷物质
ƒ甲醛、甲苯等是某些劣质建筑装饰材料释放的常见污染物
„臭氧不仅可作杀菌消毒剂,高空的臭氧层对人类也有重要保护作用
…在水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少其对空气的污染,这种做法应用的原理是电泳
†实验室中的氯酸钾、高锰酸钾等强氧化剂可以研磨使其颗粒变小
‡氰化物是有毒药品,不能入口或者接触伤口
A† B…†‡ C…†‡ Dƒ…
2、草酸(H2C2O4)溶液与酸性KMnO4溶液反应,在两溶液混和时看不到明显现象,但过一段时间后,混和溶液突然迅速褪色,此反应的化学方程式为:2KMnO4+3H2SO4+5H2C2O4
=K2SO4+2MnSO4+10CO2+8H2O,据你的分析,突然褪色的原因可能是
A.溶液已混和均匀了
B.生成微量的K2SO4起催化作用
C.生成微量的Mn2+起催化作用
D.增大了外界的压强
3、实验室用二氧化锰和浓盐酸共热制氯气时,有14.6g氯化氢被氧化,将所得气体全部用石灰乳吸收,可得漂白粉(成分为氯化钙和次氯酸钙)的质量为
A.25.4g B.50.8g C.12.7g D.14.3g
4、下列说法正确的是
A. 复分解反应中,弱酸和强酸盐反应一定不能反应制得强酸
B. 熔融态的氯化钠导电属于物理变化
C. Fe(OH)3胶体和MgCl2溶液共同具备的性质之一是分散质微粒可通过滤纸
D.含有金属元素的离子一定都是阳离子;只含有非金属元素的离子一定都是阴离子
5、.化学上鉴定S2O32-的方法之一是使用AgNO3溶液作试剂,将溶液逐渐滴入含有S2O32-的溶液中时,会有以下反应:
Ag++2S2O32-
== [Ag(S2O3)2]3- 3Ag++[Ag(S2O3)2]3-
==2Ag2S2O3
Ag2S2O3+H2O
== Ag2S¯+H2SO4 对于S2O32-的鉴定,下列叙述不正确的是
A.该鉴定可在酸性或碱性溶液中进行 B.该鉴定只能在中性溶液中进行
C.AgNO3必须过量
D.
S2- 对鉴定有干扰
6、下列说法中不正确的是
A.化工中的“三酸”“两碱”是指硫酸、硝酸、盐酸、氢氧化钠、碳酸钠
B.医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关 C.硫酸的消费量常被视为一个国家工业发达水平的一种标志
D.能源、信息、材料通常被称为新科技革命的三大支柱
 7、下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
7、下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
 |
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
8、工业上燃烧硫铁矿(第一步4FeS2+11O2 2Fe2O3+8SO2)制取硫酸(按触法),若要生产1.6吨98%的浓硫酸需要标准状况下的空气(设空气中氧气占![]() )多少立方米?
)多少立方米?
A.2464m3 B.672m3 C.3360m3 D.896m3
9、物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是
A ①③ B ③④ C ①② D ①③④
10、下列离子方程式正确的是
A硫酸铝溶液与过量Ba(OH)2溶液反应
2Al3+ + 3SO42- +3 Ba2++8OH-=3BaSO4↓+2A1O2- +4H2O
B碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+=CO2↑+H2O
C 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+02↑
D 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO
二、选择题(本题包括10小题,每小题4分,共40分。每小题有1~2个选项符合题意)
11、氯酸(HClO3)是一种强氧化性酸,若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是
A.氯酸铜 B. 高氯酸铜 C. 氯化铜 D. 氢气
12、下列各组离子在碱性条件下可以大量共存,在酸性条件下因发生氧化还原反应而不能大量共存的是
A Cu2+ Fe2+ NO3- Cl - B K+ Mg2+ HCO3- SO42-
C S2- Na+ K+ SO32- D Ba2+ Na+ I- NO3-
13、按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是
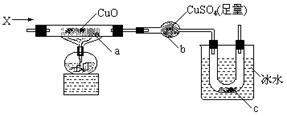
A.H2 B.CO和H2 C.CH3CH2OH(气) D.NH3
14、某研究性学习小组为了探索镁粉和溴水反应的机理,做了如下四组实验:(1)将镁粉投入冷水中,未见任何现象;
(2)将镁粉投入溴水中,观察到的只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
(3)将镁粉投入液溴中,未观察到任何明显现象;
(4)向加入足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁和溴水的反应机理的论述正确的是
A.镁粉只直接和溴水中的溴反应 B. 镁粉只直接和溴水中的酸反应
C. 产生极少量的气泡是由于镁粉和水反应得到的
D. 镁粉在水的催化下可和溴反应
15、m g H2和n g He的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比m/n>1
D.同温同压下,H2与He的密度比为1∶2
16、将下列物质分别加到溴水中,振荡后,因发生化学变化而使溴水褪色的是:
①硫化钠②氢氧化钠③乙酸④镁粉⑤裂化汽油⑥甲苯
A.①②③⑤ B. ②④⑤⑥
C. ①②④⑤ D. ②③④⑤
17、过碳酸钠(Na2CO4·H2O)加稀酸反应生成氧气和二氧化碳,在密闭容器中取一定量的过碳酸钠、NH4Cl和足量镁粉混合加强热,该高温下最终固体成分可能是
A.Na2CO4、NH4Cl、Mg B.NaCl、MgO、C、NH4Cl
C.NaCl、MgO、C D.NH4HCO3、Mg(OH)2、Na2CO4
18、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
19. 在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是
(A)![]() (B)
(B)![]()
(C)![]() (D)
(D)![]()
20、设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.32g硫与足量铜完全反应转移的电子数为NA
C.7.8 g Na2O2含有的阴离子数目为0.2 NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
08届高三化学第一次统测题
第II卷(非选择题,共80分)
三、本题共有4小题,共38分。
21. (4分)下列说法中,正确的是(填序号)_____________
A AgCl+NaBr=AgBr+NaCl能在水中进行,是因为AgBr比AgCl更难溶于水
B 用渗析法分离淀粉中混有的氯化银杂质 C 可以用分液漏斗将甘油和水的混合液体分离 D 用碱式滴定管量取20.00毫升高锰酸钾溶液
E 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
F 在氢氧化铁胶体中加入少量硫酸会产生沉淀
G硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
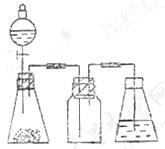
22.(10分)研究性学习小组进行SO2的制备及性质探究实验。
(1) 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
① 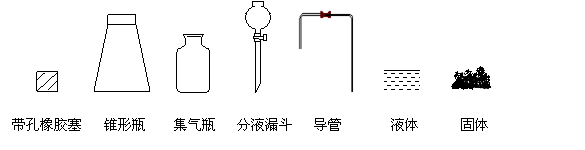 用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是________________。
(2)将SO2气体分别通入下列溶液中:
①溴水溶液,现象是________________________________________。
②硫化钠溶液,现象是_____________________________________。
23. (14分)某天然碱的化学组成可能为aNa2C03·bNaHC03·cH2O(a、b、c为正整数),为确定其组成,某同学作了如下探究:(1)定性分析
取少量天然碱样品放人试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
(2)定量分析
该同学设计了下图所示装置,测定天然碱的化学组成。

实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 ;A处碱石灰的作用是: 。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U形管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓人空气数分钟。
④关闭活塞Kl、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞Kl,缓缓鼓人空气数分钟,然后称得装浓硫酸的洗气瓶的质量为88.5g;装碱石灰的U形管D的质量为75.8g。该步骤中鼓入空气时缓缓的目的是 。计算推导:该天然碱的化学式为 。
(3)讨论:有的同学认为:E装置是可以省略的,你的观点是 (“能”或“不能”)理由是: 。
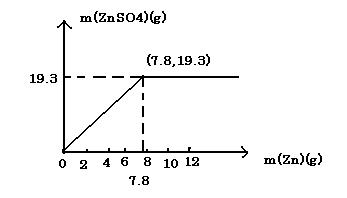
24、(10分)某学生为了测定某稀硫酸的物质的量浓度,用不同质量的纯锌粉与该硫酸进行反应。他的六次实验结果如下(计算结果精确到0.1):
| 实验编号 | 加入锌粉的质量(g) | 稀硫酸的体积(mL) | 生成硫酸锌的质量(g) |
| 1 | 2.0 | 50.0 | 5.0 |
| 2 | 4.0 | 50.0 | |
| 3 | 6.0 | 50.0 | 14.9 |
| 4 | 8.0 | 50.0 | 19.3 |
| 5 | 10.0 | 50.0 | |
| 6 | 12.0 | 50.0 | 19.3 |
(1)第2、第5组两实验中生成硫酸锌的质量分别是 g和 g 。
(2)请在下图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉的质量[m(Zn)]的关系图(需要标明关键点的横坐标和纵坐标)。
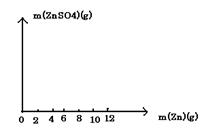 (3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为 g ;该稀硫酸的物质的量浓度为
mol/L。
(3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为 g ;该稀硫酸的物质的量浓度为
mol/L。
四、本题共4小题,共42分。
25、(12分)过氧化氢(H202)是一种无色透明粘稠状液体,它的水溶液俗称双氧水,呈弱酸性,一种强氧化剂,漂白剂,消毒剂,是生产过氧化物的原料。
(1)写出H202的电子式 ,
(2) H202与强碱反应可生成正盐,一定条件下也生成酸式盐,写出NaOH与H202反应生成酸式盐的化学方程式: 。
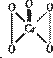 (3)在H202中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:
(3)在H202中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:
②这个反应是否是氧化还原反应? ,其理由是
(4)双氧水属于____(A强电解质、B弱电解质、C非电解质、D以上都错),它被称为“绿色氧化剂”,理由是__________________________________。
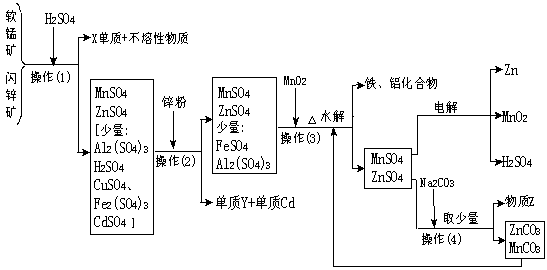 26、(10分)某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
26、(10分)某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
请回答:
(1)Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式:
____________________________________。
(5)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点: ____________________________________________。
27、(12分)某工厂废液中含有大量![]() 、
、![]() 、
、![]() ,用下列图示方法进行分离利用(部分反应条件省略):(已知试剂z是医药工业中常用的有甜味的白色晶体)
,用下列图示方法进行分离利用(部分反应条件省略):(已知试剂z是医药工业中常用的有甜味的白色晶体)
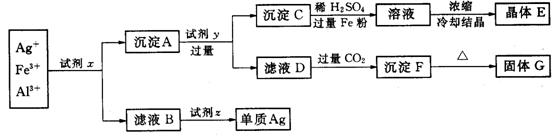
(1)写出下列物质的化学式:
试剂x________、试剂z________、晶体E________、固体G________.
(2)写出下列反应的离子方程式:
沉淀A+试剂y:___________;滤液D+过量![]() :_______________________
:_______________________
28、(8分)臭氧(O3)能与KI溶液反应, 生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量, 将0℃、1.01×105Pa的空气33.6m3通过KI溶液, 使反应完全, 在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点, 反应为:
![]()
(1)臭氧通入KI溶液中的化学方程式是 ,每消耗1molO3,转移__________ mol e-
(2)计算大气中臭氧的体积分数。(写出计算过程)
08届高三化学第一次统测题参考答案
一、选择题。1 A 2 C 3 A 4 C 5 A 6 B 7 B 8 C 9 A 10 A
二、选择题 11BD 12CD 13C 14D 15BD 16C 17C 18AC 19AB 20A
三、本题共有4小题,共38分。
21. AEFG(4分,每个1分,错选多选倒扣分)
22. (10分) (1) ①(4分)如图配置
②(2分)打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2) ①溶液褪色(2分)
②有浅黄色沉淀(或溶液变浑浊) (2分)
23. (14分)(1)不能说明。因为天然碱样品中的“NaHC03”加热分解也可产生水。(2分)
(2)①检查装置的气密性 除去通入空气中的C02和H20(4分,每空2分)
⑤使反应生成的C02和H20被充分吸收(防止气流速度过快,二氧化碳、水蒸气未被完全吸收)(2分)
计算推导:Na2C03·2NaHCO3·H20(3分)
(3)“不能”(1分)空气中的二氧化碳、水蒸气等杂质气体进人到D中,影响二氧化碳的测定。(2分)
24(10分)
(1)9.9g ; 19.3g (2)
(3)2.2+m 2.4
四、本题共4小题,共42分。
25(12分)
![]()
(2)H202+NaOH=NaHO2+H20(2分)
(3)①4H202+Cr2O7-+2H+=2CrO5+5H20(2分)
②否 (1分) 因为Cr元素的化合价未发生变化(1分)
(4)D 因为过氧化氢作氧化剂时,其还原产物是无毒无害的水(4分)
26、(10分)(1)(2分) 铜 Na2SO4
(2)(2分)ⅡB 三 (3)过滤(2分)
(4)(2分)MnO2+MS+2H2SO4==MnSO4+ MSO4+S+2H2O
(5)(2分)新工艺不需要高温焙烧,大大节约了能源(燃料)(或旧工艺高温焙烧产生大气污染物SO2,新工艺不产生有害气体;或新工艺许多物质都可以循环利用)
27、(12分)
(1)(各2分)![]()
![]()
![]()
![]() (2)(各2分)
(2)(各2分)![]()
![]()
![]()
![]()
![]()
![]()
28、(8分)
(1)2KI + O3 + H2O = 2KOH + O2 + I2 (2分) 2 (2分)
(2)(4分)解: n(Na2S2O3) = 0.0100mol·L-1×60.0×10-3L = 6.00×10-4mol(1分)
设: 33.6m3空气中O3的物质的量为x。
关系式:
2Na2S2O3 ~ O3 (1分)
2mol 1mol
6.00×10-4mol x
x = 3.00×10-4mol (1分)
空气中O3的体积分数 = ![]() = 2.00×10-5%(2分)
= 2.00×10-5%(2分)
|
三、本题共有4小题,共38分。
21. ___________(4分,每个1分,多选倒扣分)
22.(10分)(1) ①
|
|
②________________________________________________________________
__________________________________________________________
(2) ①______________________________
|
23.(14分)(1)___________________________________________________
________________________________________________
(2)①__________________________________________
_______________________________________________________
⑤___________________________________________________
化学式为:______________________
(3)________
____________________________________________________________
24、(10分)
 (1)__________和____________
(1)__________和____________
(2)
(3)___________ ____________
四、本题共4小题,共42分。
25(12分)
(1)______________________________
(2)______________________________________
(3)① ____________________________________
②___________ ____________________________________________
(4)___________ ______________________________________________
26、(10分)
(1)Y的名称 、Z的化学式为 。
(2)锌属 族,X在 周期。
(3)该操作的名称为 _______________。
(4)化学方程式: ______________________________________________。
(5)优点: ____________________________________________。
27(12分)(1)试剂x_______________、试剂z_______________、
晶体E_______________、固体G____________________.
(2)写出下列反应的离子方程式:
沉淀A+试剂y:________________________________________________;
滤液D+过量![]() :______________________________________________
:______________________________________________
28、(8分)
(1) 化学方程式是 ______________________________,每消耗1molO3,转移__________ mol e-
(2)解: