08届第四次月考化学试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ试卷共8页,有21小题,满分为100分,考试时间90分钟。
2.本卷答案必须写在答题卡的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、分别填写在答题卡的相应位置上。考试结束后只需上交答题卡,考试时不能使用计算器。
4.本卷可能用到的相对原子质量: H:1 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Zn:65
★ 祝同学们考试顺利 ★
第Ⅰ卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
![]() 1.下列化学用语表达正确的是
1.下列化学用语表达正确的是
A.丙烷的分子结构模型示意图:
![]() B.Na2S的电子式:
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
2.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
3.若短周期中的两种元素可以形成原子个数比为2∶3的化合物,则这两种元素的原子序数之差不可能是( )
A.1 B.3 C.5 D.6
4.下列实验操作中错误的是
A.用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出
B.蒸发结晶时,应将溶液蒸干,并放在干燥器中冷却
C.无锈的细铁丝可以代替铂丝,做焰色反应的工具
D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
5.化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。
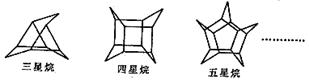 下列说法正确的是
下列说法正确的是
A.它们的一氯代物均只有三种
B.它们之间互为同系物
C.三星烷与乙苯互为同分异构体
D.六星烷的化学式为C18H24
6. 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
A. 做该实验时环境温度为22℃
B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L
D. 该实验表明有水生成的反应都是放热反应
7.以下实验装置一般不用于分离物质的是
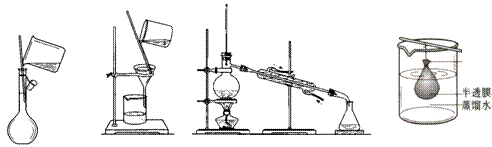 |
A. B. C. D.
8.下列有关环境问题的说法不正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH小于5.6的降水通常称为酸雨
D.含磷合成洗涤剂易导致水体污染,产生“水华”或“赤潮”现象
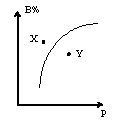 9.mA(s)+nB(g)
9.mA(s)+nB(g) ![]() pC(g),正反应为放热反应,在室温条件下B%与压强(P)的关系如图所示,则下列有关叙述正确的是
pC(g),正反应为放热反应,在室温条件下B%与压强(P)的关系如图所示,则下列有关叙述正确的是
A.n<p
B.m+n<p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率快
10.下列离子方程式书写正确的是
A.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+
B、Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:Ca2+ + OH- + HCO3- = CaCO3 ↓+ H2O
C.用铂电极电解硫酸铜溶液 2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
D、FeI2溶液中通入少量Cl2:2Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
11.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
12.NA表示阿佛加德罗常数,下列说法正确的是( )
A.常温下,1L0.1mol·L-1CH3COOH溶液中含CH3COO-数为0.1NA.......
B.标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA
C.含1mol硅原子的SiO2晶体中Si-O键的个数为NA
D.分解H2O2制O2,每生成1molO2转移4NA个电子
13.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为:CH4 +10OH- -8e- = CO32- + 7H2O ;下列叙述正确的是
A、通入甲烷的一极为正极
B、通入氧气的一极发生氧化反应
C、该电池总反应为:CH4 + 2O2+ 2OH- = CO32- + 3H2O
D、该电池在工作时,溶液中的阴离子向正极移动
14.描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )
A. 6个碳原子有可能都在一条直线上
B.分子中最多有8个原子在同一平面上
C. 6个碳原子有可能都在同一平面上
D. 6个碳原子不可能都在同一平面上
15. 0.1mol/L的NaOH溶液0.2L,通入448mL(S.T.P.)H2S气体,所得溶液离子浓度大小关系正确的是
A.c(Na+)>c(HS-)>c(OH-)>c(H2S)>c(S2-)>c(H+)
B.c(Na+)+ c(H+)= c(HS-)+c(S2-)+c(OH-)
C.c(Na+)=c(H2S)+c(HS-)+c(S2-)+c(OH-)
D.c(S2-)+c(OH-)=c(H+)+c(H2S)
16.现有100 mL 溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是
A.25mL B.5mL C.30mL D.100mL
08届第四次月考化学答题卡
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
 第Ⅱ卷(非选择题,共52分)
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共12分)
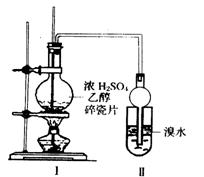
17.(12分)某化学兴趣小组用如图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯的化学方程式:
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是_____ ___ _。
A、乙烯与溴水易发生取代反应
B、使溴水褪色的物质,未必是加成反应
C、使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是_________________ _ 。为验证这一反应是加成而不是取代,可用PH试纸来测试反应后溶液的酸性,理由是____
 (4)丙同学对上述实验装置进行了改进,在I和II之增加如图装置,则A中的试剂应为______ ____ __,其作用是_____________
_________
, B中的试剂为______
__。
(4)丙同学对上述实验装置进行了改进,在I和II之增加如图装置,则A中的试剂应为______ ____ __,其作用是_____________
_________
, B中的试剂为______
__。
三、填空题(本题包括4小题,共40分)
18.(4分)下列实验操作正确的是 。
A. 使用冷凝管时,应使冷却液与被冷却的物质流动方向相同;
B. 盛过苯酚的试管可以用NaOH溶液清洗,若皮肤上沾有苯酚,应立即用酒 精洗涤;
C. 用3%的硫酸和无水乙醇加热至170℃,可以制取乙烯;
D.除去苯中的少量苯酚,可加入适量的浓溴水后再过滤;
E. 分馏原油实验中,温度计的下端不插入原油中;
F. 碳化钙是块状固体,但实验室中不用启普发生器制乙炔;
G.将苯与溴水混合后加铁屑可制取溴苯;
H. 将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在。
19.(14分)有一瓶澄清的溶液.其中可能有NH4+, K+, Mg2+, Ba2+, Al3+, Cl-, I-, NO3-, CO32-, SO42-中的几种。取该溶液进行以下实验。
(1)用pH试纸检验,表明溶液呈现强酸性,排除 的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,排除
的存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除 的存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色溶液生成,证明________存在,又排除_ 存在。
(5)综上所述,该溶液中上述离子尚不能确定是否含有的阳离子是___ ____
(6)若要确认(5)中相关离子,确认的实验方法是
。
20.(12分)气体 A只含 X、Y两种短周期 元素,X的原子序数大于 Y的原子序数。 B、D、E是中学化学中的常见气体。固体乙是一种复杂的化合物,是具有磁性的黑色晶体; F是目前用途最广、用量最大的金属单质,F与C在高温下发生反应生成E和固体乙。各物质有如下图所示的转化关系。试回答下列问题:
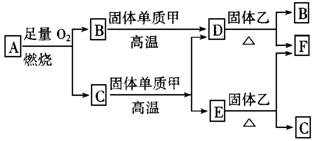
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应 ,
在高温下,F与C反应
F与足量稀HNO3反应 。
21.(10分)回答有关乙烯的几个问题:
(1)下面是乙烯与酸性高锰酸钾溶液反应的离子方程式。请标出电子转移的方向和数目。
5C2H4+12MnO4-+36H+ 10CO2+12Mn2++28H2O
(2)配平乙烯与中性或弱碱性高锰酸钾溶液反应的离子方程式(将化学式或化学计量数
填入下面相应的方框内)。
| |
| |
| |
| |
| |
| |
| |
| |
(3)乙烯和氢气组成的混合气体中碳氢两元素的质量比为12∶5,则该混合气体中乙烯
的体积分数为 。
(4)120℃、101kPa下,xL由乙烯和氢气组成的混合气体在y L O2中完全燃烧后,恢
复到原温度和压强。若燃烧后气体体积缩小0.2xL,则x与y关系的数学表达式为 。
08届第四次月考化学参考答案
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | D | B | D | B | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | B | B | B | C | C | D | C |
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共12分)
|
|
(2) B、C
(3)液体分层,油状液体在下层; 若发生取代反应,生成HBr,水溶液PH明显减小,若发生加成反应,水溶夜PH值将增大。
(4)NaOH溶液(其它碱液也可以),其作用是除去SO2, B中的试剂为品红溶液
三、填空题(本题包括4小题,共40分)
18.B E F;(4分)
19.(14分)
(1)CO32- (1分)
(2)NO3- (1分)
(3)Mg2+、Al3+ (1分)
(4)Ba2+,SO42- (2分)
(5)K+(1分)
(6)用一根洁净的铂丝蘸取待测液,放在火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,则含有K+,否则没有K+。(2分)
20. (12分)
(1) H2 (2分)
(2) (2)第二 (1分) IVA (1分) H:C C:H(2分)
|
|
(3) H2O+C
CO+H2 (2分) 3Fe+4H2O Fe3O4+4H2↑ (2分)
Fe+NO3-+4H+==Fe3++NO↑+2 H2O (2分)
21. (10分)
(1)5C2H4+12MnO4—
(2)3 2 4H2O—3 2 2OH—
(3)0.25(或25%)
(4) y ≧2