08届高三化学上册教学调研测试
本试卷分第1卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H一1 Ii一7 C一12 O一16 N一14 S一32
Cl一35.5 Fe一56
第1卷(选择题共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列叙述正确的是 ( )
A.目前加碘食盐中主要添加的是碘化钾
B.我国禁止汽车使用含铅汽油,其主要原因是铅资源短缺
C.绿色食品是不含任何化学物质的食品
D.臭氧是饮用水的理想消毒剂之一,原因是臭氧杀菌的能力强且又不影响水质
2.测定有机物相对分子质量常用的物理方法是 ( )
A.质谱法 B.红外光谱法 C.紫外光谱法 D.核磁共振谱法
3.氕化锂、氘化锂、氚化锂可以作为火箭发射的燃料,下列说法正确的是 ( )
A.H2、D2、T2之间互称同素异形体 B.氕化锂、氘化锂、氚化锂起催化作用
C.它们都是强还原剂 D.LiH、LiD、LiT的摩尔质量之比为1:2:3
4.下列物质结构与对应的用语表达都正确的是 ( )
A、S-C-S:二硫化碳的结构式
B.![]() :苯酚的结构简式
:苯酚的结构简式
C.![]() :氯化铵的电子式 D.
:氯化铵的电子式 D.![]() :钠离子的结构示意图
:钠离子的结构示意图
5.下列化学实验基本操作中正确的是 ( )
A.分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出
B.蒸馏时,将温度计水银球置于被蒸馏的石油液面下,且不触及蒸馏烧瓶的底部
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡并平视滴定管内液面
D.称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘
6.常温下。将铝片投入含大量下列离子的水溶液中,一定能产生两种单质的是 ( )
![]()
7.阿伏加德罗常数约为6.02×1023mol一。下列叙述中正确的是 ( )
A.常温常压下,20.0 g重水(D20)所含的中子数约为6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.通常状况下,1 mol的NO2与N2 04混合气体变为标准状况时其分子数约为6.02×1023
D.常温下,7.1 g C12与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023
8.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
![]()
![]() 则以下说法正确的是( )
则以下说法正确的是( )
A.在该条件下金刚石比石墨稳定,等质量时金刚石的能量大于石墨
B.金刚石转化为石墨为放热反应
C.石墨转化为金刚石为物理变化
D.由于石墨转化为金刚石为吸热反应,因此石墨在任何条件下都不可能转化为金刚石
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
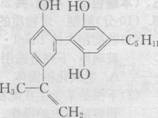 9.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右图,下列有关该物质的说法正确的是 ( )
9.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右图,下列有关该物质的说法正确的是 ( )
A.该分子中所有碳原子一定共存于同一平面中
B.1 mol该物质与足量浓溴水反应时,至少消耗4 molBr2
C.该物质属于苯酚同系物,则其遇FeCl3溶液一定显色
D.由于该物质能使酸性KMn04溶液褪色,即可证明其分子
必存在碳碳双键
10.常温下,将稀NaOH溶液与稀CH。COOH溶液混合,不可能出现的结果是 ( )
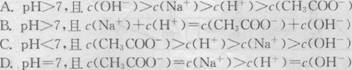
11.下述反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:
![]()
根据上述信息,手球断下列说法正确的是 ( )
A.两个反应中NaHS04均为氧化产物
B.在反应①中NaI是氧化剂,在反应②中NaI03中的碘元素被氧化
C.氧化性:Mn02>SO42一>IO3->I2
D.反应①、②中生成等量的I2时转移电子数之比为1:5
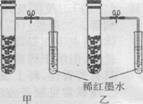 12.右图为模拟铁生锈的实验。铁粉中均匀混有少量碳粉,撒入在内壁已分别用氯化钠溶液和稀醋酸润湿过的甲、乙两支具支试管。打开止水 夹片刻后,以下有关该实验的说法合理的是 ( )
12.右图为模拟铁生锈的实验。铁粉中均匀混有少量碳粉,撒入在内壁已分别用氯化钠溶液和稀醋酸润湿过的甲、乙两支具支试管。打开止水 夹片刻后,以下有关该实验的说法合理的是 ( )
A.甲装置中红墨水倒吸量比乙装置多
B.甲装置中发生的电化学腐蚀主要是吸氧腐蚀
C.乙装置中发生的电化学腐蚀主要是析氢腐蚀
D.乙装置开始导管口有气泡冒出,接着红墨水又较快倒流
13.已知![]() 。下列关于不溶物之间转化的说法中正确的是 ( )
。下列关于不溶物之间转化的说法中正确的是 ( )
A.![]() 两者都不溶于水,因此AgCl与AgI不能相互转化
两者都不溶于水,因此AgCl与AgI不能相互转化
B.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]()
![]()
C.一定条件下AgCl可以转化为更难溶的AgI
D.只能由Ksp较大的不溶物转化为Ksp较小的不溶物
14.在大试管内依次加入20 mL蒸馏水、10 mL无水酒精、7 g硫酸铵晶体,充分振荡后静置片刻,形成液体分层、部分固体沉淀的现象;再用激光笔测试,仅上层液体出现右图所示现象。依据上述描述,判断下列说法错误
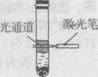 的是 ( )
的是 ( )
A.硫酸铵的溶解过程属于熵减小的过程
B.上层可能是硫酸铵在乙醇溶液中形成的胶体
C.该温度下,硫酸铵在水中的溶解度大于其在乙醇中的溶解度
D.再向该试管内滴入甲基橙试剂振荡后静置,上层液体显无色,下层液体出现红色
第Ⅱ卷(非选择题共72分)
三、(本题包括2小题,共20分)
15.(10分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物的水化物X与其氢化物Y反应生成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题:
(1)写出X与Y反应生成这种盐的化学方程式 。
(2)A、B、D、E四种元素组成的某无机盐受热易分解。写出少量该化合物与足量的 Ba(OH)2溶液反应的离子方程式 。
(3)将B的某种单质用作电极,电解E元素的最高价氧化物水化物的溶液时,阳极的电极反应式为 。
(4)在一密闭容器中注入A2、C2两种气体,发生了“![]() ”的化学反应。在某温度下达到平衡时,各物质的浓度分别是:c(A2)=9.00 mol·L-1,c(C2)
=3.00 mol·L-1,c(CA3) =4.00 mol·L-1。则此时该反应的平衡常数K=
;C2的初始浓度为mol·L-1;A2的转化率是
%。
”的化学反应。在某温度下达到平衡时,各物质的浓度分别是:c(A2)=9.00 mol·L-1,c(C2)
=3.00 mol·L-1,c(CA3) =4.00 mol·L-1。则此时该反应的平衡常数K=
;C2的初始浓度为mol·L-1;A2的转化率是
%。
16.(10分)图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
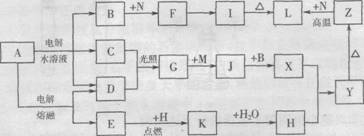
(1)工业上,在电解A溶液的设备中将阴极区和阳极区用隔开,目的是 。
(2)Z→L反应的名称是 ,K的电子式为 。
(3)写出B→F的离子方程式 。
(4)写出K与C02反应的化学方程式 。
(5)Y与NaCl0和B混合溶液作用,是制备绿色水处理剂(Na2M04)的一种方法,请写出有关反应的离子方程式 。
四、选做题(本题包括2小题,每小题12分。17(A)d、题为“物质结构与性质”模块的内容,17(B)小题为“实验化学”模块的内容。请选择其中一题作答,如果两题全做,按A题评分)
17(A).(12分)“物质结构与性质”课程模块
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。
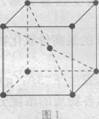

在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
17(B).(12分)“实验化学’课程模块
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:![]()
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
五、(本题包括2小题,共20分)
18.(10分)配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节。
(1)若配制大约1 mol·L-1叫的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是 (填字母序号)。
A.氢氧化钠固体B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。
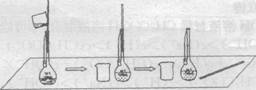
该步操作对所得溶液浓度的影响是 (填“偏高”、“偏低”或“无影响”),原因是
.
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
.
(4)现用移液管准确量取20.0 mI。0.100 mol·L-1盼碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2~3滴,此时溶液呈 色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成 色时即达到滴定终点,此时消耗盐酸体积为21.36 mI。,则待测盐酸的浓度为 mol·L-1。
![]() 19.(10分)二茂铁及其衍生物被广泛地用作火箭燃料的添加剂,汽油的抗震剂,抗辐射剂等。二茂铁[(C5H5--)2Fe2+].其分子结构如右图所示。二茂铁是橙黄色针状晶体,熔点173℃,沸点249℃,有强的热稳定性。不溶于水、稀氢氧化钠溶液和热浓盐酸,但溶于稀硝酸、浓硫酸、苯、乙醚和四氢呋喃,对空气和湿气都稳定。二茂铁具有芳香性,环上发生的反应类似于苯环。
19.(10分)二茂铁及其衍生物被广泛地用作火箭燃料的添加剂,汽油的抗震剂,抗辐射剂等。二茂铁[(C5H5--)2Fe2+].其分子结构如右图所示。二茂铁是橙黄色针状晶体,熔点173℃,沸点249℃,有强的热稳定性。不溶于水、稀氢氧化钠溶液和热浓盐酸,但溶于稀硝酸、浓硫酸、苯、乙醚和四氢呋喃,对空气和湿气都稳定。二茂铁具有芳香性,环上发生的反应类似于苯环。
二茂铁常见制备方法:
①合成法:由金属钠与环戊二烯(![]() )在四氢呋喃(
)在四氢呋喃(![]() 代号THF)溶液中反应,先制得环戊二烯钠,然后让环戊二烯钠与氯化亚铁反应制得二茂铁。
代号THF)溶液中反应,先制得环戊二烯钠,然后让环戊二烯钠与氯化亚铁反应制得二茂铁。
②电解法:电解时,以铁板和镍板作电极,电解液为碘化钠的环戊二烯溶液。
阅读以上材料,试回答下列问题:
(1)环戊二烯与二茂铁中各有 种和 种化学环境不同的氢原子。
(2)写出二茂铁与浓硫酸、醋酸酐![]() 混合发生磺化反应生成一取代物的反应式:
,并预测二茂铁能否发生硝化反应,说明理由
。
混合发生磺化反应生成一取代物的反应式:
,并预测二茂铁能否发生硝化反应,说明理由
。
(3)写出合成法制备二茂铁的相关化学方程式: 。
(4)写出电解法制备二茂铁的阳极反应 碘化钠的作用是
六、(本题包括1小题,共12分)。
20.(12分)已知:①![]()
②![]() (R为烃基);
(R为烃基);
③![]() ;④
;④![]()
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛![]() ,它是重要的化工原料,它在一定
,它是重要的化工原料,它在一定
条件下可发生以下变化:
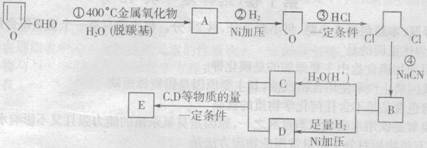
(1)反应② ④ 类型。
(2)若E为环状化合物,则其结构简式为 .
(3)写出糠醛在强碱性条件下与新制氢氧化铜反应的化学方程式 .
(4)![]() 均二氯化物有
种(不考虑立体异构)。
均二氯化物有
种(不考虑立体异构)。
(5)依据题中信息及所学知识,设计合理方案由![]() 合成
合成![]() (用反应流程图表示,并注明反应条件)
(用反应流程图表示,并注明反应条件)
例如由乙醇合成乙烯的反应流程图可表示为:
![]()
七、(本题包括1小题,共8分)
21(18分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的S02气体与足量Fe2(S04)3溶液完全反应后,用浓度为0.0200 mol·L-1的K2Cr207,标准溶液滴定至终点,消耗K2Cr207溶液25.00 mL。
![]()
(1)求样品中FeS2的质量分数(假设杂质不参加反应)。
(2)煅烧10 t上述黄铁矿,则理论上产生标准状况下的S02的体积为多少升?可制得98%的硫酸质量多少吨?
化学参考答案及评分标准
一、选择题(本题包括8小题。每小题3分,共24分。每小题只有一个选项符合题意)
1.D 2.A 3.C 4.D 5.A 6.B 7.B 8.B
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若
正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项。只选一个且正确
的得2分。选两个且都正确的得满分。但只要选错一个,该小题就为0分)
9.B 10.A 11.D 12.BD 13.BC 14.AD 。
三、(本题包括2小题,共20分)
15.(10分)
![]()
![]()
![]()
![]()
16.(10分)
(1)阳离子交换膜(1分)避免阴极区生成的OH-进入阳极区(1分)
(2)铝热反应(1分,答置换反应不得分)![]() (1分)
(1分)
![]()
![]()
![]()
四、选做题(本题包括2小题,每小题12分。17(A)小题为”物质结构与性质”模块的内容。17(B)小题为“实验化学”模块的内容。请选择其中一题作答,如果两题全做。按A题评分)
17(A).(12分)“物质结构与性质”课程模块
(1)⑩(2分)(2)sp(1分),共价键(1分写成极性共价键或d键也得分)
(3)3d54s1(1分)6(1分)
(4)![]()
(5)8(2分) 12(2分)
17(B).(12分)“实验化学”课程模块
(1)左(1分) 不能(2分) (2)B(2分)
(3)还原剂(1分) 催化剂(或指示剂)(1分)
(4)维生素C具有还原性(2分)
(5)不能(1分) 一段时间后葡萄糖全部被氧化或葡萄糖最终将被消耗尽(2分)
五、(本题包括2小题,共20分)
18.(10分)(1)ABCD(2分) (2)偏低(1分) 答出以下任一项原因就给1分:
①玻棒紧靠容量瓶口,造成洗涤液外溢。
②玻棒从容量瓶移出时,残留在玻棒上的洗涤液可能滴在瓶外。
③玻棒移出后直接放在桌面上,造成残留洗涤液损失。
④沾污玻璃棒。
(3)碳酸钠的计算量为1.06 g,而托盘天平只能称准0.1 g,即称取碳酸钠1.1 g(2分)
(4)黄(1分)红(1分)0.187(2分)
19.(10分)(1)3(1分)1(1分)(2)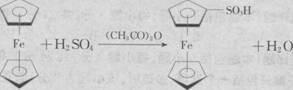 (2分)
(2分)
不能,因为浓硝酸的强氧化性会将二茂铁中的亚铁氧化(1分)
(3)![]()
![]()
(4)![]()
①I-存在可以防止Fe2+进一步被氧化(1分);②钠离子在阴极放电生成钠,钠再与环戊二烯反应生成NaC5H5和氢气(1分)
六、(本题包括1小题,共12分)
20.(12分)(1)加成(1分)取代(1分)(2)![]() (2分)
(2分)
(3)![]() (2分)
(2分)
(4)6(2分)
(5)![]() (4分)
(4分)
七、(本题包括1小题。共8分)
21.(8分)(1)90.0%(3分)(2)3.4 X 106(3分) 15(2分)
注:若离子反应,要求书写化学方程式,而学生写成离子方程式的,不扣分;凡要求书写离子方程
式,而学生写成化学方程式的,只给1分。