08届高三化学上册第14周测试题
化学反应中的能量变化测试题
(本试卷总分为100分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意
1.化学反应中常常伴有能量变化,下列说法错误的是
A 原电池是将部分化学能转化为电能
B TNT爆炸是将部分化学能转化为动能
 C 铝热反应是将部分化学能转化为热能
C 铝热反应是将部分化学能转化为热能
D 甲烷燃烧是将全部的化学能转化为热能
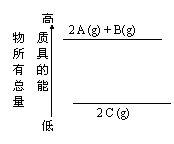
2.分析右面的能量变化示意图,确定下列选项中正确的是( )
![]() A.2 A(g)+ B(g)
2 C(g);△H<0
A.2 A(g)+ B(g)
2 C(g);△H<0
![]() B.2 A(g)+ B(g)
2 C(g);
△H>0
B.2 A(g)+ B(g)
2 C(g);
△H>0
![]() C.2A + B
2 C;△H<0
C.2A + B
2 C;△H<0
![]() D.2C
2 A +B ;△H<0
D.2C
2 A +B ;△H<0
3.已知在25、101Kpa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40KJ热量。则表示上述反应的热化学方程式正确的是 ( )
A. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(g);△H =-96.80KJ/mol
B. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H =-11035.20KJ/mol
C. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);△H =+11035.20KJ/mol
D. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(g);△H =-96.80KJ/mol
4.使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+1/2O2(g)=CO(g) △H=-Q1kJ/mol,CO(g)+1/2O2(g)=CO2(g) △H=-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是 ( )
A.1/2Q2 kJ B.1/3Q2 kJ C.1/3(Q1+Q2)kJ D.1/3Q1 kJ
5.现有 CO,H2,CO2组成的混合气体116.6升(标况),经完全燃烧后放出的总热量为867.9KJ,并生成18克H2O(L),已知2H2 (g)+O2 (g)=2H2O(L);△H=-571.6KJ/mol ,CO(g)+1/2O2=CO2 (g); △H=-282.8KJ/mol,则燃烧前混合气体中CO的体积分数最接近于 ( )
A 80% B 60% C 40% D 20%
6.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g)=N2O4(g); △H=+ 8.7kJ/mol
N2H4(g) + O2(g)=N2(g) + 2H2O(g); △H=–534 kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是
(
)
A. 2N2H4(g)
+ N2O4(g) = 3N2(g) + 4H2O(g); △H=–1076.7 kJ/mol
B. N2H4(g) +
1/2N2O4(g) =3/2N2(g) + 2H2O(g); △H=–1076.7 kJ/mol
C. 2N2H4(g)
+ N2O4(g) = 3N2(g) + 4H2O(g); △H=–542.7 kJ/mol
D. 2N2H4(g)
+ N2O4(g) = 3N2(g) + 4H2O(g); △H=–1059.3 kJ/mol
7.根据热化学方程式(101 KPa) S(s) +O2 (g)=SO2 (g); △H=-297.23KJ/mol分析下列说法不正确的是 ( )
A S的燃烧热为297.23KJ/mol
B S(g) +O2 (g)=SO2 (g) 放出的热量大于297.23KJ
C S(g) +O2 (g)=SO2 (g) 放出的热量小于297.23KJ
D 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量
8.已知某温度下的热化学方程式:2SO2(气)+O2(气)![]() 2SO3;△H=
-197KJ/mol,在同温同压下,向密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ;向另一相同的密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ。下列关系正确的是
(
)
2SO3;△H=
-197KJ/mol,在同温同压下,向密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ;向另一相同的密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ。下列关系正确的是
(
)
A.Q1=Q2=197 B.Q1=Q2<197 C.Q1<Q2<197 D.Q2<Q1<197
9.含20.0NaOH的稀溶液与稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是
A.1/2NaOH(aq)+1/2HCl(aq)=1/2NaCl(aq)+1/2H2O(l);ΔH=+28.7kJ/mol
B.1/2NaOH(aq)+1/2HCl(aq)=1/2NaCl(aq)+1/2H2O(l);ΔH=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol
10.已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H=Q1kJ/mol
![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(1)
△H=Q2kJ/mol
Na2SO4(aq)+H2O(1)
△H=Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H=Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
二、不定项选择题(本题包括5小题,每小题4分,共20分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11.热化学方程式:S(g)+O2(g)=SO2(g);△H=-297.3kJ/mol,分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(l);△H>297.3kJ/mol
B.1molSO2的键能总和大于1molS和1molO2键能之和
C.S(g)+O2(g)=SO2(l);△H<297.3kJ/mol
D.1molSO2的键能总和小于1molS和1molO2键能之和
12.将白磷隔绝空气加热到260℃可转变为红磷。以下说法正确的是
A.白磷转变为红磷是一个吸热过程 B.红磷比白磷稳定
C.白磷转变为红磷需外界提供引发反应的能量 D.白磷比红磷稳定
13.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-282.5kJ/mol。假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
A.40% B.50% C.60% D.70%
14.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
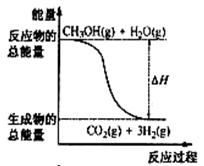
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.据盖斯定律和反应①和②可确定通常情况下氢气的燃烧热
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
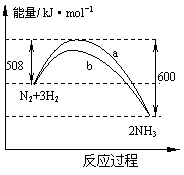 15.右图是198K时N2与H2反应过程中能量变化的( )
15.右图是198K时N2与H2反应过程中能量变化的( )
曲线图。下列叙述正确的是
A.该反应的热化学方程式为:
N2+3H2
![]() 2NH3,△H=-92kJ·mol-1
2NH3,△H=-92kJ·mol-1
B.b曲线是加入正催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1molN2和3molH2反应后放出的热 量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ则184>Q2 >2Q1
二、填空题(共50分)
1.(8分)已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480KJ。
(1)试写出乙烷气体燃烧的热化学方程式_______________ ;
(2)计算该天然气中甲烷的体积分数___________________;
(3)由上表可总结出的近似规律是____________________
(4)根据(3)的近似规律可预测癸烷的燃烧热约为________ _ kJ·mol-1。
2. (9分)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________ 。
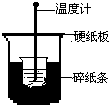 (2)烧杯间填满碎纸条的作用是_____________
。
(2)烧杯间填满碎纸条的作用是_____________
。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________;用50mL0.50mol/LNaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________(均填“偏大”、“偏小”或“无影响”)。
3. (6分) 一些盐的结晶水合物,在温度不太高时就有熔化现象,既熔溶于自身的结晶水中,又同时吸收热量,它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
| Na2S2O3·5H2O | CaCl2·6H2O | Na2SO4·10H2O | Na2HPO4·12H2O | |
| 熔点℃ | 40~50 | 29.92 | 32.38 | 35.1 |
| 熔化热(kJ/相对分子质量) | 49.7 | 37.3 | 77.0 | 100.1 |
(1)上述潜热材料中最适宜应用的两种盐是______ 、________________。
(2)实际应用时最常用的(根据来源和成本考虑)应该是_____________ 。
4. (6分) (1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为 。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为
;又知H2O(l)![]() H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
5. (2分) 已知下列热化学方程式的热效应:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H1=-26.7kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H2=-50.75kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)十CO2(g);△H3=-36.5kJ/mol
不用查表,计算下列反应的△H。FeO(s)+CO(g)=Fe(s)+CO2(g)
6. (7分)已知C(s、金刚石)+O2==CO2(g);ΔH=-395.4kJ/mol,C(s、石墨)+O2==CO2(g);ΔH=-393.5kJ/mol。且知石墨的密度大于金刚石。
(1)石墨和金刚石相比,____的稳定性更大,石墨转化为金刚石的热化学方程式为____________。
(2)石墨中C-C键键能______金刚石中C-C键键能。石墨的熔点______金刚石(均填“大于”、“小于”或“等于”)。
(3)理论上能否用石墨合成金刚石?____,若能,需要的条件是___________。
7.物质的生成热可定义为:由稳定单质生成1mol物质所放出的热量,如CO2气体的生成热就是1molC完全燃烧生成CO2气体时放出的热量,已知下列几种化合物的生成热分别是
| 化合物 | 葡萄糖 | H2O(l) | CO2 |
| 生成热kJ/mol | 1259.8 | 285.8 | 393.5 |
则1kg葡萄糖在人体内完全氧化生成CO2气体和液态水,最多可提供______kJ能量。
8. (2分)化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量。以下部分共价键键能数据:H—S 364 kJ/mol,S—S 266 kJ/mol ,S=O 522 kJ/mol ,H—O 464 kJ/mol。
(1)试根据这些数据计算下面这个反应的反应热:2H2S(g)+SO2(g)=3S(g)+2H2O; △H= —Q kJ/mol,反应产物中的S实为S8,实际分子是一个8元环状分子(如图)。求Q。
S S S S
 |
S S S S
9. (9分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:
H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:KJ·mol-1)
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 |
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性 (填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH= —QKJ/ mol;通过计算确定热化学方程式中Q的值为 。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是_________________________________。
(4)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
。
班别 姓名 座号 成绩
1.(1)_______________ ;
(2)___________________;(3)____________________
__________________
(4)________ _
2.(1)________ 。(2)____________ 。
(3)______(4)________, _________,简述理由_________________________________
________________________________ 。
(5)__________; _________。
3.(1)______ 、________________。(2)_____________ 。
4.(1) 。
(2) ;
。
5.
6. (1) ____ , ____________ 。
(2) ______ 。______ 。
(3) ____ , ___________ 。
7. 8.
9.(1) 。试预测C-Br键的键能范围_________<C-Br键能<__________。
(2) 。(3) _________________________________。
(4) 。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | A | B | A | C | A | C | D | D | C | AB | BC | B | D | BD |
2008届高三化学第14周测
二、填空题
1.:(8分)(1)2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l);△H=—3119.6kJ/mol (2分)
(2)72.13% (2分) (3)烷烃分子中每增加一个CH2燃烧热平均增加645kJ/mol左右 (2分)(4)6776(2分)
烧的热化学方程式中水为液态的水。
2:(9分)(1)环形玻璃搅拌器 (1分) (2)减少实验过程中热量损失(1分) (3)偏小 (1分) (4)不相等,(1分) 相等(1分) ,因为中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关 (2分) (5)偏小(1分) 偏小(1分)
3:(6分) (1)Na2SO4·10H2O、Na2HPO4·12H2O (2)Na2SO4·10H2O (每空2分)
评析:熔点越低,越有利于盐吸收太阳能而熔化,故排除Na2S2O3·5H2O。进一步比较单位质量吸热效率:
| CaCl2·6H2O | Na2SO4·10H2O | Na2HPO4·12H2O |
| 0.17kJ/g | 0.24kJ/g | 0.28kJ/g |
很明显,Na2SO4·10H2O、Na2HPO4·12H2O吸收率较高。又因前者比后者价廉而易获得。实际应选用Na2SO4。
4: (6分)(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol
(2)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165kJ/mol 1016.5kJ
(每空2分)
5:7.28kJ/mol
(2分)评析:由盖斯定律得所求方程的反应热为{![]() }/3。
}/3。
6: (7分)(1)石墨 (1分) C(s、石墨)== C(s、金刚石);ΔH=1.9kJ/mol (2分) (2)大于(1分) 大于 (1分)
(3)能(1分) 隔绝空气高温高压(1分)
评析:由于石墨转化为金刚石为吸热反应,故等量的石墨和金刚石相比,金刚石所具有的能量高,键能小,熔点低。
7:15640kJ(2分)
评析:根据生成热的定义得下面三个方程:6C(s)+3O2(g)+6H2(g)=C6H12O6(s);ΔH=-1259.8kJ/mol……①,C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol……②;O2(g)+2H2(g)=2H2O(l)……③,联立求解即得。 8. 154(2分)
9. (9分) (1)小于 (1分) 218~330 KJ·mol-1 (2分)
(2)185 (1分) (3)RI> RBr > RCl > RF (2分)
(4)不赞同,H2O的熔沸点高于H2S是因为水分子间存在氢键,与键能无关。(2分)