08届高中毕业班化学复习教学质量检测(二)
理科综合化学部分
6.下列离子方程式中,只能表示一个化学反应的是
①CO32-+2H+==CO2↑+H2O ②Ba2++2OH--+2H++SO42--=BaSO4↓+2H2O
③ Ag++Cl-=AgCl↓④Fe+Cu2+== Fe2++Cu⑤Cl2+H2O=====H++Cl-+ HClO
A ①③ B ②④ C ②⑤ D 只有⑤
7.根据相关事实,所的结论正确的是
A HCl的相对分子质量比HF大,故HCl的沸点比HF高
B苯不能使酸性高锰酸钾褪色,故苯没有还原性
C CO2通入苯酚钠溶液中产生浑浊,故酸性H2CO3>C6H5OH
![]() D 常温下白磷可自燃而氮气需在放电时才能与氧气反应,故非金属性P>N
D 常温下白磷可自燃而氮气需在放电时才能与氧气反应,故非金属性P>N
8.用惰性电极电解50ml锰酸钾溶液:K2MnO4 +H2O KMnO4 +H2↑+ KOH(未配平),当生成112ml氢气(标准状况)时停止通电。下列判断正确的是
A K+浓度减小 B KMnO4在阳极区生成
C阴极周围溶液的pH值减小 D 反应过程中共转移0.005mol电子
9.下列事实能说明亚硝酸是弱电解质的是
A 亚硝酸钠溶液的pH大于7
B 用亚硝酸溶液作导电试验,灯泡很暗
C亚硝酸溶液不与硫酸钠溶液反应恰好中和 需要10 gNaOH 固体
D亚硝酸能与NaOH溶液发生中和反应
10.对于短周期元素,下列说法正确的是
A.若两元素原子序数相差8,则周期数一定相差1
B.两种简单离子不可能相差3个电子层
C.同族的两元素之间不可能形成化合物
D.最外层电子数相同的元素一定位于同一族
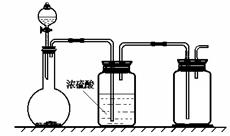 11.下图装置,用于实验室发生、干燥和收集气体。(尾气处理装置已略去)能利用这套装置进行的实验是
11.下图装置,用于实验室发生、干燥和收集气体。(尾气处理装置已略去)能利用这套装置进行的实验是
A.电石与食盐水制C2H2
B.块状大理石与稀硫酸制CO2
C.铜屑和浓硝酸制NO2
D.二氧化锰与浓盐酸制Cl2
12.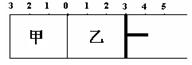 如图所示,甲容器容积固定不变,乙容器有可移
如图所示,甲容器容积固定不变,乙容器有可移
动的活塞。甲中充入2 mol SO2和1mol O2,乙中
充入2 mol SO3和1mol He,在恒定温度和催化剂条件下,甲、乙达到如下平衡:
2SO3(g) ![]() 2SO2(g)+ O2 (g)。根据活塞位置,下列有关说法正确的是
2SO2(g)+ O2 (g)。根据活塞位置,下列有关说法正确的是
A.若活塞固定在3处不动,达平衡时两容器中的压强相等
B.若活塞固定在3处不动,达平衡时两容器中SO3的浓度相等
C.若活塞固定在4处不动,达平衡时两容器中SO3的物质的量分数相等
D.若活塞固定在5处不动,达平衡时乙容器中SO2的物质的量较小
13.某芳香族酯类化合物甲的分子式为C14H10O5,1mol甲水解后只生成一种产物乙,其物质的量为2mol,下列说法正确的是
A.符合上述条件的甲共有3种 B.1mol甲最多可以和3molNaOH反应
C.乙不能和溴水发生反应 D.2mol乙最多消耗1molNa2CO3
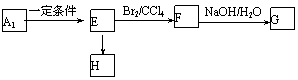
26.(14分)下列A~G均是中学常见化合物,它们之间有如图的转化关系(部分反应物或生成物略去),已知B为气体,E、F、G三种化合物中均含有同一种元素甲,且价态互不相同。
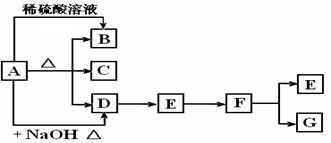
(1)甲元素为________。
(2)B是________或_________,写出两种鉴别它们的方法__________;_________。
(3)若A与G反应也能制B,且反应中n(A):n(G)= 1:2,则此时该反应的离子方程式是
。
(4)若B与F在一定条件下反应生成一种化合物和一种单质,该反应的化学方程式为 。
27.(15分)(1)在温度t℃下,某溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,该温度下水的离子积Kw=_______;t______25(填“大于”、“小于”或“等于”)。
(2)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
x = _____。Ba(OH)2溶液物质的量浓度为__ _。
⑶常温下,向100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH_____7(填“大于”、“小于”或“等于”);原混合溶液中硫酸钠的物质的量浓度为 。
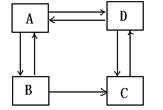 28.(16分)化合物A、B、C、D 均为饱和一元含氧衍生物,下图中涉及的7个转化均为中学化学中常见反应
28.(16分)化合物A、B、C、D 均为饱和一元含氧衍生物,下图中涉及的7个转化均为中学化学中常见反应
(1)B的分子中一定含有的官能团是 (填名称)
C的分子中一定含有的官能团是 (填结构简式)
(2)指出反应类型:A→B
C→D
 (3)A的一种同系物A1不能实现上述转化,且A1是该类物质中相对分子质量最小的。则A1的结构简式为_____。
(3)A的一种同系物A1不能实现上述转化,且A1是该类物质中相对分子质量最小的。则A1的结构简式为_____。
(4)已知A1有如下转化关系,
其中H为高分子化合物,则H的结构简式为 ,
写出F→G转化的化学方程式
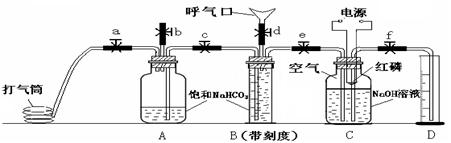 29.(15分)人体呼出气体中含有N2、O2、CO2、水蒸气等多种成分。某课外学习小组利用下图装置测定N2、O2、CO2的百分含量(忽略水蒸气等微量成分)。其中B是带刻度的量气装置。
29.(15分)人体呼出气体中含有N2、O2、CO2、水蒸气等多种成分。某课外学习小组利用下图装置测定N2、O2、CO2的百分含量(忽略水蒸气等微量成分)。其中B是带刻度的量气装置。
试验步骤:
①先检验装置的气密性。在向装置中装入药品(如图所示),其中C瓶溶液上方为100ml已除尽CO2的空气(N2和O2的体积比为4/1)。
②打开止水夹b、c、d,关闭止水夹e,向B瓶吹气后关闭d,并冷却到室温,收集到V1ml气体。
③关闭b,打开止水夹a、c、e、f,用打气筒向A瓶中缓缓充气,直到B中气体刚好全部排出,此时量筒中液面读数为V2ml。
④关闭e、f,降低燃烧匙的高度,用电火花引燃红磷。
⑤等C瓶冷却到室温,打开f1最终量筒液面读数为V3ml。
回答下列问题:
(1)A、B中装饱和NaHCO3而不能装饱和Na2CO3溶液的原因是
(2)C装置中红磷要过量的目的是 。
(3)反应结束后,C瓶溶液中含有溶质的化学式为
(4)利用上述数据计算人体呼出气体中氧气所占体积百分数为
CO2所占体积百分数为
(5)步骤⑤中C瓶还未冷却到室温就打开止水夹读数,这样会使所测氧气体积分数 (填“偏大”或“偏小”)。
(6)严格按①~⑤进行试验后测得数据仍有一定误差,可能的原因是
理科综合化学部分参考答案
第Ⅰ卷(选择题 共48分)
6、D 7、C 8、B 9、A 10、A 11、C 12、B 13、A
第Ⅱ卷(非选择题 共60分)
26.(共14分)
(1)N或氮(2分)(2)SO2 CO2(每空1分,共2分);将B通入品红溶液,如溶液退色,则为SO2,如不退色,则为CO2;将B通入酸性KMnO4溶液中,如褪色,则为SO2,如不褪色,则为CO2;(每空2分,共4分)(其他合理答案也给分)
(3)2H++CO32— == CO2↑+H2O(3分,答出生成SO2 的反应不得分)
(4)2NO2+4SO2 == N2+4SO3(3分)
27.(共15分)
(1)1×10-12;大于(每空2分,共4分)(2)2;5×10-3mol·L-1(每空3分,共6分)
(3)大于(2分);0.01mol·L-1(3分)
28.(共16分)
![]()
(1)醛基(2分); (2分) (2)氧化反应(2分);酯化反应(2分)
![]() (3)
(3)
![]() (2分) (4) (2分);
(2分) (4) (2分);
![]()
(4分)
29.(共15分)
(1)Na2CO3能够吸收CO2(2分)
(2)耗尽其中的氧气(2分)
(3)NaOH 、Na2CO3、Na3PO4(NaPO3)(每个1分,共3分)
![]() (4)
(4)
(2分) (V1 —V2)/V1 (2分)
(5)偏小(2分)
(6)测量读数时,各装置中液面不在同一水平面上,压强差会造成体积的误差;未考虑导管中残存气体对测定结果的影响;极少量的氧气、氮气溶解(其他合理解答也可,答出一点即可,2分)